استون:
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه فنی و مهندسی
| استون | |
|---|---|
| شناسنامه | |
| نامگذاری آیوپاک پروپانون | |
| نامهای دیگر | دی متیل کتون، β-کتوپروپان |
| فرمول مولکولی | CH3COCH3 |
| SMILES | CC(=O)C |
| جرم مولی | 58.09 g/mol |
| نما (ظاهر) | مایع بیرنگ |
| CAS number | [۶۷-۶۴-۱] |
| ویژگیها | |
| چگالی و فتن (حالت) فیزیکی | 0.79 g/cm3, آبگونه (مایع) |
| حلالیت در آب | حل شدنی |
| دمای ذوب | -۹۴٫۹ °C (178.2 K) |
| دمای جوش | ۵۶٫۳ °C (329.4 K) |
| توان اسیدی (pKa) | ? |
| توان بازی (pKb) | ? |
| چرخش دستگردی [?]D | ? ° |
| گران روی | 0.32pcP در۲۰ °C |
| ساختار | |
| نمای مولکولی | سه گوش با دو راستا بر روی C=O |
| گشتاور دوقطبی | ۲٫۹۱D |
| ترکیبهای وابسته | |
| کتونهای وابسته | بوتانون |
| حلالهای وابسته | آب اتانول ایزوپروپانول تولوئن |
| به جز بخشهای گفته شده، دادههای داده شده دربارهٔ ی مادهها در سامههای استاندارد (در ۲۵°C، ۱۰۰ کیلو پاسکال) بستهٔ دادههای شیمیایی وسرزدنیها (مرجعها) ی ویکیپدیا |
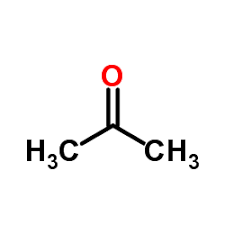
اَسِتون(نامگذاری ایوپاک “پروپانون”) سادهترین کتون با فرمول مولکولی CH3)2CO) و یکی از لکهبرها است. این ماده توسط حییم وایزمن کشف شدهاست. این ماده فرار، بیرنگ و به شدت آتش گیر است و مصرف بسیار زیادی در صنعت به عنوان حلال دارد.
یکی از سادهترین روشهای ساخت این ماده تقطیر استاست.
کاربرد استون
کاربرد استون برای تولید – تینرها – رنگ – چسب – لوازم آرایشی – پارچه و…میباشد استون با توجه به ویژگی های منحصر به فرد خود کاربرد های گسترده ای در صنعت و مصارف دیگر دارد. یک سوم مقادیر تولید شده این ماده به عنوان حلال و لکه بر (پاک کننده) در ترکیبات آلی استفاده می شود. این در حالیست که یک چهارم کل ماده تولیدی در مواد سازنده متیل، متاکریلات اسید، متیل متاکریلات (MMA) مانند استون سیانوهیدرین استفاده می شود. این مواد در مراحل بعدی برای تولید محصولات اکریلیک (PMMA) مانند ورقه های اکریلیکی استفاده می شوند.
حلال مواد شیمیایی
استون به طور کلی به عنوان حلال در فرمولاسیون مواد زیر استفاده می شود:
- پلی اکریلات ها
- صنایع الکتریکی
- اکریلیک و رنگ ها
- چسب و واکس ها
- رنگ برای عصاره گیری
- کفپوش های براق کننده
- جوهرهای چاپ در پرینترها
- رزین الکل های نیترو سلولز
- مواد دارویی و لوازم آرایشی
- حمل کننده استيلن سيلندرها
- گریس ها، چربی ها و روغن ها
- صنایع سیمان و بی دود کردن پودرها
- رزین های آلکیدی و پلی وینیل استات
- صنعت رزین های طبیعی و مصنوعی
- چربی گیری فلزات پیش از رنگ آمیزی
- پوشش های سطوح مواد شوینده، تمیز کننده و تینر ها
این ماده همچنین در تولید حلال های دیگر اعم از متیل ایزوبوتیل کتون و متیل ایزوبوتیل الکل کاربرد دارد. از حلال های وابسته به این ماده می توان به آب، اتانول، تولوئن و ایزو پروپانول اشاره کرد.