پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
همه چیز درباره طیف سنجی نشر اتمی (AES)
مقدمه
طیفسنجی نشر اتمی (AES) روشی برای تجزیه و تحلیل شیمیایی است که از شدت نور تابیده شده از شعله، پلاسما، قوس یا جرقه در طول موج ویژه استفاده میکند تا مقدار عنصر را در یک نمونه مشخص کند. طول موج خط طیف اتمی در طیف انتشار، هویت عنصر را نشان میدهد در حالی که شدت نور تابیده شده با تعداد اتمهای عنصر متناسب است.
اساس کار طیف سنجی نشر اتمی
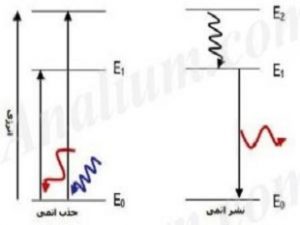
اساس روش های طیف سنجی نشر اتمی (Atomic Emission Spectroscopy) با نام اختصاری AES اندازه گیری شدت نشر یون یا مولکول در حالت گازی است. یون ها یا مولکول های گازی شکل که الکترون های لایه ظرفیت آنها بر اثر گرما، واکنش شیمیایی یا جریان الکتریکی تهییج می شوند، تابش های مشخصی در طول موج های مرئی و ماوراء بنفش دارند. مانند طيف جذبی، در طيف نشری هر عنصر نیز طول موج هاي معينی وجود دارد كه از ويژگی های مشخصه آن عنصر است. يعنی طيف های نشری و جذبی هيچ دو عنصري مثل هم نيست. اندازه گیری تابش نشر شده عنصر مورد نظر کاربرد زیادی در آنالیز کمی و کیفی عناصر فلزی و شبه فلزی دارد. شکل زیر شمای کلی فرایند جذب و نشر اتمی بین دو تراز انرژی را نشان می دهد.
شدت نشر خودبخودی تابشی توسط یک اتم از رابطه زیر بدست می آید:
Iem=AjihνjiNj (1)
که در آن Iem شدت نور تابشی، Aji احتمال انتقال برای نشرخودبخودی، h ثابت پلانک، νji فرکانس تابشی و Nj تعداد اتم در حالت برانگیخته است. تعداد اتم های برانگیخته و در نتیجه شدت نشر متناسب با غلظت اتم ها ست. بنابراین رسم شدت نشر بر حسب غلظت یک خط صاف خواهد بود (در غلظت های پایین)..
اگر تعادل ترمودینامیکی برقرار باشد رابطه توزیع بولتزمن برای غلظت اتم ها در حالت برانگیخته و پایه به صورت زیر بیان خواهد شد:
Nj/No=(gj/go)e-Ej/kT (2)
که در آن Nj و No تعداد اتم ها در حالت برانگیخته (ترازj ) و تراز پایه، gj و go وزن های آماری این ترازها، Ej اختلاف انرژی تراز برانگیخته و پایه، K ثابت بولتزمن و T دما ( برحسب کلوین) هستند.
در طیف سنجی نشر اتمی، تابش نشر شده توسط اتم های تهییج شده متناسب با غلظت اتم ها ست در صورتی که در جذب اتمی تابش جذب شده به وسيله اتم های تحريک نشده تعيين می شود. تعداد اتم های تهییج شده نسبت نمایی با دما دارد. بنابراین شدت نشر که به تعداد اتم های تهییج شده بستگی دارد به مقدار زيادی تحت تاثير دما قرار می گيرد. در حالی که در طیف سنجی جذب اتمی، که تعداد اتم های تهییج نشده بااهمیت است، شدت جذب مستقيما تحت تاثير دمای اتم ساز قرار نمی گيرد.
دستگاهوری طیف سنجی نشر اتمی
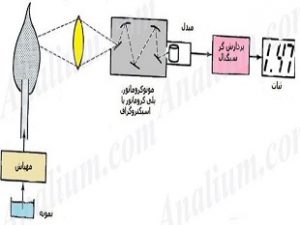
طیف سنجی نشر اتمی از نظر دستگاهوری (Instrumentation) شبیه طیف سنجی جذب اتمی ست جز این که به منبع تابشی در روش نشری نیازی نیست. به همین علت به راحتی با خاموش کردن منبع تابشی (معمولا HCL) می توان یک طیف سنجی جذب شعله را به یک طیف سنجی نشرشعله تبدیل کرد. اما بیشتر روش های نشری به دلیل استفاده از منابع اتمی کننده و تهییجی اختصاصی تری مانند پلاسما، قوس، جرقه و لیزر طراحی های پیچیده تری دارند. اجزا کلی یک طیف سنج نشری در شکل زیر نشان داده شده است.
منبع تابش
همان طور که گفته شد تعداد اتم های تهییج شده طبق توزیع بولتزمن نسبت نمایی با دما دارند (رابطه 2). بنابراین شدت نشر به مقدار زيادی تحت تاثير دما قرار می گيرد. به همین علت اتم سازها، نقش بسیار تعیین کننده ای در آنالیز و اندازه گیری های طیف سنجی نشر اتمی دارند. اتم سازها در روش های نشری ضمن حلال زدایی، تبخیر و اتمی کردن نمونه، وظیفه تهییج اتم ها را نیز بر عهده دارند و بنابراین به عنوان منبع تابش نیز عمل می کنند. طیف سنجی نشر اتمی بر اساس منابع تهییج به چند دسته کلی زیر تقسیم می شوند:
-
طیف سنجی نشر اتمی شعله
-
طیف سنجی نشر اتمي پلاسما
-
طیف سنجی نشر اتمي قوس و جرقه
-
طیف سنجی نشر اتمی تخلیه تابش
طیف سنج
همان طور که گفته شد طیف های نشری بسیار پیچیده تر و شلوغ تر از طیف های جذبی هستند. بنابراین طیف سنج (Spectrometer) در نشر اتمی اهمیت بسیار ویژه تری نسبت به روش های جذب دارد. ضمن اینکه همه عناصر موجود در نمونه نیز بعد از تهییج در منبع تابش به طور همزمان طیف نشری خود را منتشر می کنند. بنابراین واضح است که از این روش برای اندازه گیری چند عنصری استفاده شود.
برای طیف سنجی نشر اتمی شعله، که دمای کمتری دارد و برای آنالیز عناصر قلیایی و قلیایی که طیف نشری ساده ای دارند به کار می رود، از فیلتر فومتر برای تفکیک طول موج استفاده می شود.
تفکیک طول موج برای طیف های بسیار پیچیده نشری حاصله از پلاسما، قوس و جرقه الکتریکی که دمای بالاتر دارند، نیاز به وسایل نوری پیشرفته تری دارد. این تجهیزات باید بتوانند تفکیک طول موجی بالا (حداقل 0.01nm)، محدوده دینامیکی گسترده، شناسایی و انتخاب صحیح طول موج، پایداری بالا در برابر تغییرات محیطی و تصحیح زمینه آسانی داشته باشند.
طیف سنج ها در این دستگاه ها شامل تک فام ساز، آشکارساز و یک مبدل هستند. طیف سنج ها بر اساس عملکردشان در تفکیک طول موج و در نتیجه آنالیز عنصری به دو نوع ترتيبی (Sequential) و همزمان (Simultaneous) تقسیم می شوند.
طیف سنج ترتیبی (Sequential spectrometer)
در دستگاه های ترتیبی در هر زمان شدت نشری یک عنصر اندازه گیری می شود یعنی به صورت متوالی و پشت سرهم شدت خط نشری عناصر مورد نظر یک به یک اندازه گیری می شود. طیف سنج های ترتیبی اغلب شامل یک گریتینگ (grating) یا توری هستند که با چرخش کنترل شده طول موج های مورد نظر را به ترتیب بر روی شکاف خروجی متمرکز می کند. در این نوع دستگا ها آشکارساز در هر زمان فقط یک طول موج را اندازه گیری می کند و معمولا هم از آشکار ساز PMT استفاده می شود. برای اندازه گیری چند عنصر دستگاه های ترتیبی زمان بسیار بیشتری برای آنالیز مورد نیار است بنابراین اگرچه این دستگاه ها ساده تر و ارزان تر هستند ولی مصرف نمونه بیشتر و زمان آنالیز بالاتری دارند.
طیف سنج همزمان (simultaneous spectrometers)
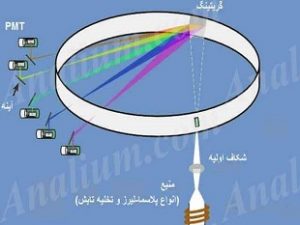
طیف سنج های همزمان یا چند کاناله (multichannel) شدت خط نشری همه عناصر مورد نظر در یک زمان اندازه گیری می شود. تابش از میان توری های چند رنگ کننده گذر می کند و روی شکاف هاي گوناگون بازتابانده می شود به گونه اي که هر شکاف طول موج ویژه اي را پدید می آورد. دونوع عمومی دارند: چندرنگ کننده ها (Polychromator) و اسپکتروگراف (Spectrograph). پلی کروماتورها برای اندازه گیری و آنالیز همزمان چند عنصر استفاده شده و از چندین آشکار ساز PMT برای اندازه گیری شدت طیفی استفاده می کنند. عمومی ترین آرایش یا چیدمان یک اسپکترومتر چند کاناله با آشکار ساز PMT به دایره رولند (Rowland circle) معروف است که در شکل زیر به صورت شماتیک نشان داده شده است:
اسپکتوگراف ها شامل یک سری آشکارسازهای کوچک فوتوحساس هستند. این آشکارسازهای به گونه ای در کنار هم قرار گرفته اند که تمام عناصر یک دسته پرتو پاشیده شده از مونوکروماتور را هم زمان اندازه گیری می کند. دو نوع آشکار ساز دستگاه انتقال بار (Charge transfer devices) شامل دستگاه شارژ تزریقی (Charge-Injection Devices, CID) و دستگاه شارژ جفتی (Charge-Coupled Devices, CCD) از انواع متداول آشکارسازهای مورد استفاده در اندازه گیری های چند کاناله همزمان هستند.
در وسایل انتقال بار برخورد فوتون با سطح دیود تولید جفت های حفره- الکترون می کند. حفره-الکترون های مثبت به طور آزادانه در نیمه هادی نوع P حرکت می کند اما الکترون ها در خارن های ذخیره می شوند. هر خازن دارای یک الکترود کوچک نیز هست که با اعمال پتانسیل مثبت به این الکترود سبب می شود الکترون های تولید شده در زیر لایه عایق به دام بیافتند. با جاگذاری درست الکتردهای فلزی به راحتی یک آرایه دو بعدی ایجاد می شود. تفاوت CCD و CID در نوع بازخوانی آنهاست. در CCD بازخوانی به صورت انتقال پیاپی بار به آمپلی فایر صورت می گیرد اما در CID بازخوانی با انتقال بار بین الکترودهای مجاور انجام می شود. این سبب می شود نوع CID دسترسی تصادفی سریعتر و زمان های انتگرال گیری بیشتری را داشته باشد.
نکات آنالیزی روش های طیف سنجی نشر اتمی
-
امکان آنالیز کمی و کیفی عناصر فلزی و شبه فلزی
-
برای بیشتر عناصرحد تشخیص در محدوده (g/mL, mg/μL) یا ppm و (g/μL) یا ppb
-
امکان اندازه گیری مستقیم نمونه های جامد ( روش قوس و جرقه الکتریکی)
-
اندازه گیری هم زمان چند عنصری
-
عدم نیاز به منبع تابش نور
-
مزاحمت نشری در آنالیزهای کمی
-
تجهیرات گرانتر و شرایط اپراتوری پیچیده تر نسبت به روش های طیف سنجی جذب اتمی