پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
آنچه که باید در مورد جدول تناوبی بدانید
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
آنچه که باید در مورد جدول تناوبی بدانید
مقدمه
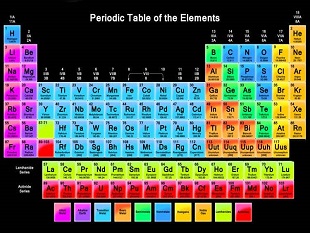
جدول تناوبی عنصرهای شیمیایی یا جدول مندلیف به انگلیسی: Periodic table یا periodic table of elements)، نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد اتمی (شمار پروتونهای) کمتر به سوی عدد اتمی بالاتر است. شکل استاندارد این جدول ۱۸ × ۷ است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار بلوک مستطیلی عبارتند از: بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی (فلزات واسطه) در وسط و بلوک اف (فلزات واسطهٔ داخلی) در پایین. ردیفهای این جدول، دوره و ستونهای آن، گروه های جدول تناوبی نام دارند. همچنین گاهی برخی از این گروهها نامهای ویژهای دارند. برای نمونه گروه هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی، چه به شکل مستطیلی و چه به شکلهای دیگر، بررسی بهتر ویژگیهای شیمیایی عنصرها بودهاست. این جدول، کاربرد زیادی در دانش شیمی و پردازش رفتار عنصرها دارد.
جدول تناوبی با نام دیمیتری مندلیف شناخته شدهاست، با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او این جدول را در سال ۱۸۶۹ منتشر کرد. این، نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را تهیه کرد تا ویژگیهای دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و جای آنها را خالی گذاشته بود. کمکم با پیشرفت دانش، عنصرهای تازهای شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیهسازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گستردهتر شدهاست.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (اوگانسون) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از اوگانسون هستند و البته این پرسش را پیش رو دارند که عنصرهای تازهتر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شدهاست.
ویژگی های ظاهری جدول تناوبی
همهٔ نسخههای جدول تناوبی تنها دربردارندهٔ عنصرهای شیمیایی هستند و مخلوط، ترکیب یا ذرهٔ زیراتمی در آنها جایی ندارد. هر عنصر شیمیایی یک عدد اتمی یکتا دارد و این عدد برابر با شمار پروتونها در هستهٔ اتم آن عنصر است. اتمهای گوناگون یک عنصر میتوانند شمار نوترونهای متفاوتی داشته باشند. در این حالت به آنها ایزوتوپ گفته میشود. برای نمونه کربن سه ایزوتوپ طبیعی دارد. همهٔ ایزوتوپهای کربن ۶ پروتون، و بیشتر آنها ۶ نوترون دارند؛ اما یک درصد آنها ۷ نوترون و شمار بسیار کمتری از آنها ۸ نوترون دارند. ایزوتوپها در جدول تناوبی به صورت جداگانه، نمایش داده نمیشوند؛ بلکه میانگین آنها به عنوان جرم اتمی در زیر عنصر درج میشود. برای عنصرهایی که هیچ ایزوتوپ پایداری ندارند، جرم اتمی پایدارترین یا متداولترین ایزوتوپ آنها درون پرانتز نوشته میشود.
در جدول تناوبی استاندارد عنصرها به ترتیب عدد اتمی (شمار پروتونها در هسته)، به صورت صعودی مرتب شدهاند. هر ردیف تازه در جدول، که یک دوره یا تناوب نامیده میشود، با افزوده شدن نخستین الکترون به یک لایهٔ الکترونی تازه آغاز میشود. عنصرهایی که در یک ستون جدول (گروه) جای گرفتهاند، همگی در لایهٔ آخر الکترونی خود دارای تعداد الکترونهای برابر هستند؛ به عبارت دیگر آرایش الکترونی لایهٔ آخر آنها یکسان است. مانند اکسیژن و سلنیم که هر دو در یک ستون هستند و هر دو چهار الکترون در لایهٔ بیرونی آرایش الکترونی خود یعنی تراز p دارند. عنصرهایی که ویژگیهای شیمیایی مشابه دارند، معمولاً در یک گروه از جدول قرار میگیرند. اما در بلوک f عنصرهایی که در یک دوره هستند نیز ویژگیهای مشابهی را نشان میدهند. در نتیجه به آسانی میتوان ویژگیهای شیمیایی یک عنصر را با آگاهی از عنصرهای پیرامونیاش پیشبینی کرد.
تا سال ۲۰۱۵، جدول تناوبی ۱۱۸ عنصر داشتهاست که ۱۱۴ عنصر به صورت رسمی از سوی اتحادیه بینالمللی شیمی محض و کاربردی پذیرفته و نامگذاری شدهاند. ۹۸ عنصر از مجموع ۱۱۸ عنصر در طبیعت یافت میشوند و از آن میان، ۸۴ مورد، عنصرهای پایدار یا دارای نیمعمر بیش از سن زمین هستند. در حالی که ۱۴ عنصر باقیمانده نیمعمر کوتاهی دارند یا به عبارت دیگر پرتوزا هستند. در حال حاضر، این عنصرها تنها بر اثر انجام واکنش هستهای در عنصرهای دیگر به وجود میآیند و فراوانی ناچیزی دارند. تمام عنصرهای با عدد اتمی ۹۹ تا ۱۱۲ (که مابین اینشتینیم و کوپرنیسیم قرار دارند) و نیز دو عنصر فلروویوم و لیورموریوم، در طبیعت پدید نیامدهاند، بلکه در آزمایشگاه ساخته شدهاند. سپس آیوپاک آنها را بهطور رسمی پذیرفتهاست. گزارش شده که عنصرهای ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ هم در آزمایشگاه ساخته شدهاند، اما هنوز آیوپاک آنها را تأیید نکردهاست. برای همین، این عنصرها هنوز بر پایهٔ عدد اتمیشان شناخته میشوند. تاکنون عنصری سنگینتر از کالیفرنیم (عنصر ۹۸) در طبیعت به صورت خالص در اندازهٔ قابل مشاهده، پیدا نشدهاست. تا سال ۲۰۱۸ هنوز عنصری با عدد اتمی بزرگتر از ۱۱۸ ساخته نشدهاست.
روش دستهبندی
عنصرها در جدول تناوبی به صورت افقی (چپ به راست) در دورههای ۱ تا ۷ و به صورت عمودی (بالا به پایین) در گروههای ۱ تا ۱۸ دستهبندی میشوند. همچنین دستهبندی دیگری بر اساس لایهٔ الکترونی در حال پر شدن وجود دارد که بر اساس آن، عنصرها در بلوکهای s و p و d و f قرار میگیرند.
گروه
یک گروه یا خانواده، یک ستون عمودی از جدول تناوبی است. عنصرهای یک گروه معمولاً ویژگیهای نزدیک به هم بیشتری نسبت به عنصرهای یک دوره یا بلوک دارند. دانش مکانیک کوانتوم که دربارهٔ ساختار اتمی پژوهش میکند، نشان میدهد که چون عنصرهای موجود در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی برخوردارند؛ بنابراین ویژگیهای شیمیایی مشابهی از خود نشان میدهند و هرچه عدد اتمی آنها بالاتر میرود، این مشابهتها افزایش پیدا میکند. با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ همانندیها در یک گروه مهم هستند. به همانندی (شباهت) در یک دوره، همانندی افقی و در یک گروه، همانندی عمودی گفته میشود.
بر اساس یک قرارداد جهانی، گروهها از ۱ تا ۱۸ شمارهگذاری شدهاند که گروه شمارهٔ یک را نخستین گروه از چپ (فلزهای قلیایی) و آخرین گروه را گروه نخست از راست (گازهای نجیب) در نظر گرفتهاند. در گذشته، شمارهٔ گروهها را با عددهای رومی نشان میدادند. همچنین در آمریکا برای گروههای بلوک اس و پی یک حرف A و برای عنصرهای بلوک دی یک حرف B در کنار شمارهٔ رومی گروه میگذاشتند. برای نمونه گروه چهار به صورت IVB و گروه چهاردهم (یا عنصرهای گروه کربن) به صورت IVA نمایش داده میشد. در اروپا هم همین روش به کار میرفت، با این تفاوت که حرف A برای گروههای پیش از گروه ۱۰ و حرف B برای عنصرهای گروه ۱۰ و گروههای پس از آن بکار میرفت. در سال ۱۹۸۸ آیوپاک سامانهٔ نامگذاری تازهای را پیشنهاد کرد و روشهای پیشین همگی فراموش شد.
ویژگیهای عنصرهای یک گروه مانند شعاع اتمی، انرژی یونش و الکتروندوستی مشابه یکدیگر هستند. از بالا به پایین، شعاع اتمی عنصرها افزایش مییابد، در نتیجه الکترونهای لایهٔ آخر در فاصلهٔ دورتری از هسته جای میگیرند، چون ترازهای انرژی بیشتری پُر شدهاند. از بالا به پایین، انرژی یونش کاهش مییابد. چون الکترونها کمتر به هسته پیوند خوردهاند و آسانتر میتوان آنها را جدا کرد. با تحلیل مشابه، از بالا به پایین الکتروندوستی عنصرها کاهش مییابد. چون فاصلهٔ میان الکترونهای لایهٔ آخر و هسته افزایش مییابد. البته در این میان استثناهایی هم وجود دارد. برای نمونه در گروه ۱۱ الکتروندوستی از بالا به پایین افزایش مییابد.
دوره
یک دوره در جدول تناوبی، یک ردیف افقی از این جدول است. با اینکه عنصرها در یک گروه همانندیهای بسیاری دارند، اما بخشهایی از دورهها هستند که از اهمیتی بیش از گروهها برخوردارند. مانند بلوک F، جایی که لانتانیدها و آکتینیدها دو مجموعهٔ افقی از عنصرهای جدول را میسازند.
عنصرها در یک دوره همانندیهایی از لحاظ شعاع اتمی، انرژی یونش، الکتروندوستی و الکترونخواهی (مقدار انرژی آزاد شده هنگامی که یک الکترون به یک مولکول یا اتم خنثی افزوده میشود) از خود نشان میدهند. در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد. این پدیده، به این دلیل است که با افزایش عدد اتمی در یک دوره، شمار لایههای الکترونی ثابت است، اما شمار پروتونها افزایش مییابد. برای همین الکترونها بیشتر به سوی هسته کشیده میشوند. کاهش شعاع اتمی باعث افزایش انرژی یونش میشود (از چپ به راست). هرچه پیوندها در یک عنصر محکمتر باشد، انرژی بیشتری هم برای جداسازی یک الکترون نیاز است. الکتروندوستی مانند انرژی یونش رفتار میکند و از چپ به راست افزایش مییابد. چون کشش هسته بر روی الکترونها افزایش مییابد. همچنین مقدار الکترونخواهی هم در طول یک دوره اندکی تغییر میکند. فلزها (عنصرهای سمت چپ دوره) معمولاً نسبت به نافلزها (سمت راست دوره) الکترونخواهی پایینتری دارند. این قانون برای گازهای نجیب برقرار نیست.
بلوک
چون لایهٔ آخر الکترونی از اهمیت ویژهای برخوردار است، جدول تناوبی به بخشهایی وابسته به این لایههای الکترونی تقسیم شدهاست. به هر یک از این بخشها یک بلوک میگویند. بلوک اس دربردارندهٔ دو گروه نخست جدول (فلزهای قلیایی و قلیایی خاکی) و دو عنصر هیدروژن و هلیم است. بلوک پی دربردارندهٔ شش گروه آخر جدول، گروههای ۱۳ تا ۱۸ آیوپاک (۳A تا ۸A در نامگذاری آمریکایی) است. همهٔ شبهفلزات و نافلزها در این بلوک جای میگیرند. بلوک دی دربردارندهٔ گروههای ۳ تا ۱۲ آیوپاک (۳B تا ۸B در نامگذاری آمریکایی) و همهٔ فلزات واسطه است. بلوک اف که بیشتر در پایین بدنهٔ اصلی جدول جای میگیرد دربردارندهٔ لانتانیدها و اکتینیدها است.
تاریخچه
در سال ۱۷۸۹ آنتوان لاووازیه فهرستی از ۳۳ عنصر شیمیایی را منتشر کرد. او این عنصرها را زیر نامهای گازی، فلزی، نافلزی و خاکی دستهبندی کرده بود. سپس در دههٔ ۱۷۹۰ یرمیا بنیامین ریشتر جدول وزن معادل را تهیه کرد. به این منظور، مقدار وزنی اسیدهایی که با یک مقدار مشخص باز ترکیب میشدند و نیز مقدار فلزهایی که با مقدار مشخصی اسید ترکیب میشدند را اندازهگیری کرد. در سال ۱۸۲۹ یوهان ولفگنگ دوبرآینر دریافت که بسیاری از عنصرها را میتوان بسته به ویژگیهای شیمیایی آنها، در دستههای سهتایی بخشبندی کرد. برای نمونه لیتیم، سدیم و پتاسیم را با هم در دستهٔ فلزهای واکنشپذیر نرم گذاشت. همچنین او متوجه شد که وقتی عنصرها را به ترتیب وزن اتمی دستهبندی میکند، وزن عنصر دوم (میانی) تقریباً برابر است با میانگین وزن عنصر پیش و پس از خود (عنصر اول و سوم). این پدیده به نام قانون سهتایی یا سهتایی دوبرآینر شناخته شد. شیمیدان آلمانی لئوپولد گملین با همین روش ادامه داد و تا سال ۱۸۴۳ توانست ده دستهٔ سهتایی، سه دستهٔ چهارتایی و یک دستهٔ پنجتایی را شناسایی کند. در سال ۱۸۵۷ ژان باتیست آندره دوما توانست ارتباطهایی میان دستههای گوناگون فلزها به دست آورد. تا این دوره شیمیدانان گوناگون توانسته بودند ارتباطهای گوناگونی میان دستههای کوچک عنصرها به دست آورند؛ اما هیچیک جدول کلی ارائه نکردهبودند.
در ۱۸۵۸ شیمیدان آلمانی فریدریش آگوست ککوله مشاهده کرد که کربن همواره با چهار اتم پیرامون خود پیوند برقرار میکند. برای نمونه در متان یک کربن با چهار هیدروژن پیرامون خود پیوند خوردهاست. این مفهوم کمکم با نام والانس یا الکترونهای ظرفیت شناخته شد. منظور از والانس یک اتم، تعداد اتمهایی است که با آن اتم پیوند میخورند.
در ۱۸۶۲ یک زمینشناس فرانسوی به نام الکساندر-امیل بگویه دو شانکورتوآ یک نمای اولیه از جدول تناوبی را منتشر کرد و نام آن را «مارپیچ خاکی» یا «مارپیچ» گذاشت. او نخستین کسی بود که متوجه ویژگیهای تناوبی عنصرها شد و آنها را به ترتیب عدد اتمی از کمتر به بیشتر در یک استوانهٔ مارپیچ مرتب کرد. همچنین او نشان داد که عنصرهایی که ویژگیهای مانند هم دارند در فاصلهای ثابت از هم قرار دارند (شمار عنصرهای میان آنها همیشه ثابت است). جدول او برخی یونها و ترکیبها را هم دربرداشت. مقالهای که او دربارهٔ جدول خود منتشر کرد، بیش از دانش شیمی، به مطالب مربوط به زمینشناسی پرداخته بود. برای همین تا پیش از جدول دیمیتری مندلیف توجه کمی را به خود جلب کرد.
در ۱۸۶۴ شیمیدان آلمانی، جولیوس لوتار میر جدولی ساختهشده از ۴۴ عنصر را بر پایهٔ الکترونهای لایهٔ ظرفیت (والانس) ارائه کرد. این جدول نشان میداد که عنصرهایی که ویژگیهای مانند هم دارند، معمولاً الکترونهای ظرفیت برابر هم دارند. همزمان شیمیدان انگلیسی، ویلیام آدلینگ هم جدولی ساختهشده از ۵۷ عنصر منتشر کرد. جدول آدلینگ بر پایهٔ وزن اتمی بود که چندین جای خالی و نکتهٔ غیرمعمول در آن دیده میشد. او متوجه مفهوم تناوبی بودن جرم اتمی در میان عنصرها و مسئلهٔ گروهبندی عنصرها در جدول شده بود اما هرگز پیگیر ادامهٔ آن نشد. او در ۱۸۷۰ عنصرها را برپایهٔ الکترونهای لایهٔ ظرفیت (والانس) مرتب کرد و به عنوان جدول پیشنهادی خود ارائه کرد.
شیمیدان انگلیسی جان نیولندز از سال ۱۸۶۳ تا ۱۸۶۶ مجموعه مقالاتی را منتشر کرد. او در این مقالهها توضیح میداد که هنگامی که عنصرها به ترتیب از عدد اتمی کمتر به بیشتر مرتب شوند در دستههای هشتتایی ویژگیهای فیزیکی و شیمیایی مشابهی را تکرار میکنند. او این تناوب و تکرار هشتتایی را به هشتگانهای موسیقی همانند کرد. قانون هشتگانهای نیولندز از سوی همکارانش احمقانه دانسته شد و جامعهٔ شیمی حاضر به انتشار کار او نشد. برخلاف این برخورد، نیولندز دادههای جدول هشتایی خود را جمعآوری کرد و از آن برای پیشبینی عنصرهای ناشناخته مانند ژرمانیم بهره برد. جامعهٔ شیمی پنج سال پس از آنکه جدول تناوبی مندلیف به جهان معرفی شد، به کار نیولندز بها داد.
در سال ۱۸۶۷ یک شیمیدان زادهٔ دانمارک به نام گوستاووس هینریشس یک جدول تناوبی مارپیچ پیشنهاد کرد. این جدول برپایهٔ طیف اتمی، وزن و شباهتهای شیمیایی بود. جدول او به عنوان کاری «منحصربهفرد»، «درخور توجه» و البته «تودرتو و پیچیده» دانسته شد. چنین توصیفاتی مانع از شناسایی و پذیرش عمومی جدول او شد.
جدول مندلیف
استاد روس شیمی، دیمیتری مندلیف و شیمیدان آلمانی، ژولیوس لوتار میر، هر یک به صورت مستقل جدولی را به ترتیب در سالهای ۱۸۶۹ و ۱۸۷۰ منتشر کردند. جدول مندلیف، نخستین نسخه از کار او بود؛ درحالی که جدولی که میر منتشر کرد، نسخهٔ گسترش یافتهٔ جدول پیشین او بود که در سال ۱۸۶۴ منتشر کرده بود. هر دو نفر، عنصرها را در ردیفها و ستونها به ترتیب وزن اتمی فهرست کرده بودند. در هر دو جدول در آغاز یک ستون یا ردیف، ویژگیهای عنصرها به صورت مرتب تکرار میشد.
مندلیف در این جدول دو انتخاب مهم انجام داده بود که باعث شد تا جدول او مورد پذیرش عمومی قرار گیرد: نخست اینکه جای عنصرهایی را که هنوز شناسایی نشده بود، خالی گذاشته بود. مندلیف نخستین شیمیدانی نبود که چنین کرده بود، اما نخستین کسی بود که با توجه به ردپایی که از جدول داشت، جای عنصرها را پیشبینی کرده بود. عنصرهایی مانند گالیم و ژرمانیم عنصرهایی بودند که بعداً شناسایی شدند. انتخاب دوم مندلیف در جایگذاری و دستهبندی عنصرها بود، او گاهی ویژگی وزن اتمی را نادیده گرفته بود و به جای آن، عنصرها را با توجه به ویژگیهای شیمیایی جایگذاری کرده بود. عنصرهایی مانند تلوریم و ید از این دست بودند. بعدها با پیشرفت علم معلوم شد که مندلیف نادانسته عنصرها را به ترتیب افزایش عدد اتمی و بار هسته مرتب کرده بود.
اهمیت عدد اتمی در جایگذاری عنصرها در جدول تناوبی نادیده گرفته میشد تا اینکه وجود و ویژگیهای پروتون و نوترون در هسته شناسایی شد.
گسترش جدول تناوبی
مندلیف در سال ۱۸۷۱ جدول خود را به روز کرد و جزئیات بیشتری از عنصرهایی که جای آنها را پیشبینی میکرد، ارائه داد. او باور داشت که این عنصرها وجود دارند، اما هنوز شناسایی نشدهاند. با گذر زمان و شناسایی عنصرهایی که به صورت طبیعی یافت میشوند، جاهای خالی کمکم پر شد. باور عمومی چنین است که آخرین عنصر شناسایی شدهای که به صورت طبیعی پدید میآید، فرانسیم است که در سال ۱۹۳۹ شناسایی شد. مندلیف این عنصر را «اکا-سزیم» (اکا به معنی همانند) نامیده بود. پس از آن، در سال ۱۹۴۰ عنصر پلوتونیم به صورت آزمایشگاهی تولید شد؛ اما در سال ۱۹۷۱ دانشمندان به این نتیجه رسیدند که این عنصر به صورت طبیعی ساخته میشود.
جدول تناوبی پرکاربرد امروزی که به نام جدول تناوبی استاندارد یا جدول تناوبی متداول نیز شناخته میشود، جدولی است که به شیمیدان آمریکایی هوراس گرووز دمینگ نسبت داده میشود. دمینگ در ۱۹۲۳ دو نسخهٔ کوتاه (نسخهٔ مندلیفی و ۱۸ ستونی ) جدول تناوبی را منتشر کرد. بعدها در سال ۱۹۲۸ نسخهٔ ۱۸ ستونی جدول دمینگ به صورت گسترده در دسترس مدرسههای آمریکا قرار گرفت. تا دههٔ ۱۹۳۰ جدول دمینگ در بسیاری از کتابها و دانشنامههای شیمی در دسترس بود. همچنین برای سالها توسط انتشارات علمی سرجنت-ولچ منتشر میشد.
با پیشرفت دانش مکانیک کوانتوم و افزایش دانش دربارهٔ الکترونها و نقش آنها در اتم، روشن شد که جایگیری عنصرها در هر دوره (ردیف) از جدول تناوبی با پر شدن یکی از لایههای الکترونی همسنگ است. اتمهای بزرگتر، الکترونها و در نتیجه زیرلایههای بیشتری دارند. پس با افزایش شمارهٔ دوره، طول دورههای جدول بیشتر میشود.
در ۱۹۴۵، دانشمند آمریکایی گلن سیبورگ گفت که الکترونها در اکتینیدها مانند لانتانیدها بلوک اف از لایههای الکترونی را پر میکنند. چرا که پیش از آن فرض میشد که الکترونهای لایهٔ آخر این عنصرها در بلوک دی جای میگیرند. همکار سیبورگ به او توصیه کرد که چنین مطلبی را منتشر نکند و آیندهٔ کاری خود را به خطر نیندازد. با این حال، او پیشنهاد خود را ارائه داد که از سوی جامعهٔ علمی درست دانسته شد. سیبورگ به تلاش خود ادامه داد و در سال ۱۹۵۱ توانست جایزهٔ نوبل شیمی را به خاطر کار بر روی اکتینیدها از آن خود کند.
آشنایی با رشته شیمی آلی , ویژگی ها و کاربردهای آن
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
آشنایی با رشته شیمی آلی , ویژگی ها و کاربردهای آن
مقدمه
شیمی آلی زیر مجموعهای از دانش شیمی است که دربارهٔ ترکیبات کربن یا مواد آلی سخن میگوید، عنصر اصلی که با کربن ترکیبات آلی را تشکیل میدهند، هیدروژن میباشد.
در گذشته به موادی که ریشه گیاهی یا حیوانی داشتند، مواد آلی (ارگانیک) میگفتند اما امروزه مواد آلی را میتوان از طریق روشهای صنعتی و آزمایشگاهی و به کمک مواد معدنی نیز سنتز کرد. در فرهنگهای فارسی معنای کلمه «آلی» مربوط به اندامهای موجود زنده و هر موجودی که دارای آلات، اجزا، یا اندامهای متعدد باشد، آمده است.
شیمی آلی شالوده زیستشناسی و پزشکی است. ساختمان موجودات زنده به غیر از آب، عمدتاً از مواد آلی ساخته شدهاند، مولکولهای مورد بحث در زیستشناسی مولکولی همان مولکولهای آلی هستند. امروزه ما در عصر کربن زندگی میکنیم، هر روزه روزنامهها و مجلات، ذهن ما را متوجه ترکیبات کربن نظیر کلسترول، چربیهای اشباع نشده، هورمونها، استروئیدها، حشره کشها و فرومونها مینماید. در دهههای گذشته به خاطر نفت، جنگهای متعددی راه افتادهاست، همچنین دو فاجعه نازک شدن لایه اوزون که عمدتاً به خاطر وجود کلروفلوئوروکربنها میباشد و پدیده گازهای گلخانهای که ناشی از حضور متان، کلروفلوئوروکربنها و دیاکسید کربن است، زندگی انسانها را به خطر انداختهاست.
ماهیت
موادی که از منابع آلی بدست میآیند، در یک ویژگی مشترک هستند و آن اشتراک در دارا بودن عنصر کربن است. دو منبع بزرگ مواد آلی که از آنها مواد آلی با ترکیبات ساده، تأمین میشوند، نفت و زغال سنگ هستند، این دو ماده فسیلی در مفهوم قدیمی آلی بوده و حاصل تجزیه جانوران و گیاهان هستند. این ترکیبات ساده به عنوان مصالح ساختمانی، در ساختن ترکیبات بزرگتر و پیچیدهتر مصرف میگردند. شیمی آلی، شیمی ترکیبات کربن با سایر عناصر به ویژه هیدروژن، اکسیژن، نیتروژن، هالوژنها و غیر فلزات دیگر نظیر گوگرد و فسفر است. همچنین فلزاتی مثل منیزیم، مس و پالادیم هم در برخی ترکیبهای آلی حضور دارند. الکلها، اترها، هیدروکربنها، آلدئیدها، کتونها، کربوکسیلیک اسیدها، ترکیبات آلیفاتیک حلقوی، ترکیبات آروماتیک (مانند بنزن)، آمینها، فنلها، درشت مولکولها و بسپارها (پلیمر) و نظیر آنها جزء مواد آلی بوده و مباحث شیمی آلی را به خود اختصاص دادهاند.
کاربردها
امروزه از مواد آلی و دانش شیمی آلی در رنگ سازی، کاغذ و جوهرسازی، مواد غذایی، پوشاک، پتروشیمی، مواد پلاستیکی و لاستیکی، داروسازی، پزشکی و دهها صنعت دیگر بهره میبرند. افزون بر بیست میلیون ترکیب شناخته شدهٔ کربن وجود دارد و هر ساله نیم میلیون مولکول جدید به خانواده مواد آلی اضافه میشوند.
ساختمان و ویژگی های مواد آلی
آرایش و درشتی مولکولهای مواد آلی
تا حدود سال ۱۸۵۰ میلادی بسیاری از دانشمندان بر این باور بودند که منشأ مواد آلی، جانداران و گیاهان هستند، آنها تصور میکردند که مواد آلی را هرگز نمیتوان از مواد معدنی و غیر آلی تولید نمود. دانشمندان همواره دنبال پاسخ به این پرسش بودند که چه ویژگی در ترکیبات کربن وجود دارد که آنها را از ترکیبات مربوط به صد و چند عنصر دیگر جدول تناوبی متمایز کردهاست. تعداد بسیاری از ترکیبات کربن وجود دارند که مولکولهای آنها میتوانند بسیار بزرگ و پیچیده باشند. تعداد ترکیباتی که دارای عنصر کربن هستند چندین برابر بیشتر از تعداد ترکیبات بدون کربن است. مولکولهای آلی شامل هزاران اتم شناخته شدهاند و ترتیب قرار گرفتن اتمها حتی در مولکولهای نسبتاً کوچک نیز بسیار پیچیدهاست.
ویژگی منحصر به فرد کربن
اتمهای کربن میتوانند به میزانی که برای اتم هیچ عنصر دیگری مقدور نیست، به یکدیگر متصل شوند. همچنین اتمهای کربن میتوانند زنجیرهایی شامل هزاران اتم یا حلقههایی با اندازههای متفاوت ایجاد نمایند، زنجیرها و حلقهها میتوانند دارای شاخه و پیوندهای عرضی باشند، به اتمهای کربن این زنجیرها و حلقهها، اتمهای دیگری نیز میتواند وصل شود، این اتمها معمولاً هیدروژن، فلوئور، کلر، برم، ید، اکسیژن، نیتروژن، گوگرد، فسفر و سایر اتمهای مختلف میباشند. هر آرایش مختلف از اتمها مربوط به ترکیب متفاوتی است و هر ترکیب یک سری خواص شیمیایی و فیزیکی خاص خود را دارد، از این رو غیرمنتظره نیست که امروزه دهها میلیون ترکیب شناخته شده کربن وجود داشته باشد.
پیوند شیمیایی
بررسی ساختمان مولکولها را باید با بحث دربارهٔ پیوندهای شیمیایی یعنی نیروهایی که اتمها را در یک مولکول نگاه میدارند، شروع نمود. دو نوع پیوند یونی و کووالانسی، پیوندهایی هستند که به وسیله آن اتمها با یکدیگر اتصال برقرار میکنند. از میان این دو پیوند، پیوند کووالانسی، پیوند متداول در ترکیبات کربن است و مهمترین پیوند در مطالعه شیمی آلی است.
بازارکار
مشاغل زیر به طور مستقیم به این رشته تحصیلی ارتباط دارد و دانش آموختگان در صورت فعالیت در این شغل بیشترین ارتباط را بین رشته تحصیلی و شغل خود برقرار خواهند کرد :
شیمی دان پژوهشگر استاد دانشگاه معلم
همچنین برخی از مشاغل، ظرفیت جذب افراد مختلف از تخصص های گوناگون را دارا می باشند. در این مشاغل، هر فرد علاوه بر تسلط بر مهارت های مربوط به آن شغل، لازم است به فراخور صنعت و نوع کسب و کاری که در آن مشغول به کار است، دارای دانش تخصصی مربوطه نیز باشد:
کارشناس / مدیر آموزش کارگزار بیمه
معرفی رشته شیمی تجزیه و کاربرد آن
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی