پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
خوردگی فلزات در شیمی

مقدمه
خوردگی فلزات فرآیندی است که در آن فلزات به اعداد اکسایش اصلی خود میرسند. درحقیقت، خوردگی فلزات یک واکنش اکسایش و کاهش است که در آن، فلز توسط محیط اطراف خود اکسید میشود. به طور معمول، اکسیژن هوا در این فرآیندها نقش اکسنده دارد. این واکنش از نظر الکتروشیمی نیز جزو واکنشهای محبوب و خود به خودی به حساب میآید. به عبارت دیگر، این فرآیند شامل تشکیل یک سلول گالوانی است که در آن فلز مورد بحث به صورت آند عمل میکند و به طور معمول دچار خوردگی یا از بین رفتن عملکرد خود میشود.
شرایط خوردگی فلزات
برای بروز این پدیده، وجود سه جزء اصلی الزامی است:
-
فلز
-
-
الکترولیت
بسیاری از فلزاتی که در صنایع تولیدی استفاده میشوند، به طور طبیعی در سنگ معدنها وجود دارند و باید از آنها جداسازی شوند. این فلزات همچون آهن، به طور خود به خودی به حالت اولیه خود باز میگردند. بررسی فلزات در قالب «سریهای گالوانی» (Galvanic Series) به ما در فهم احتمال خوردگی آنها کمک میکند.
این پدیده به عنوان تخریب مواد با استفاده از واکنشهای شیمیایی نیز شناخته میشود. مهمترین این فرآیندها، واکنشهای الکتروشیمیایی است که در آن اکسید شدن یک فلز در حضور یک پذیرنده الکترون سرعت مییابد.
علاوه بر این، همانطور که اشاره شد، این پدیده را میتوان به صورت بازگشت فلزات به سنگ معدنهای خود نیز تعریف کرد.
نحوه شروع خوردگی
خوردگی فلزات از دو راه بروز میکند: یا به صورت سطحی و در سطح فلز یا به صورت موضعی.
خوردگی سطحی
این نوع از خوردگی فلزات فقط در شرایط اسیدی بوجود میآید که به صورت کاملا یکنواخت در سطح فلز اتفاق میافتد و در نهایت سبب ورقه ورقه شدن فلز میشود.
خوردگی موضعی
معمولترین نوع خوردگی موضعی (حفرهای)، پوسیدگی و ایجاد حفرات است. با بروز این پدیده در یک نقطه و ایجاد حفره، پوسیدگی صورت میگیرد. پیشگیری از این نوع خوردگی فلزات معمولا بسیار پیچیده و شناسایی آن قبل از وقوع برای مهندسان دشوار است.
خوردگی به عنوان یک فرآیند الکتروشیمیایی
این پدیده حاصل انجام واکنشهای اکسایش و کاهش است که با واکنش در باتریها مقایسه میشود. فلز خورده شده به عنوان یک آند عمل میکند و با اکسید شدن، یونها و الکترونهای آزاد را تشکیل میدهد. الکترونهای آزاد، اکسیژن را کاهش میدهند و در بیشتر موارد موجب تشکیل هیدروکسید و واکنش کاتدی میشوند. تجزیه فلز در آند دو پیامد را به دنبال دارد: یونهای فلزی میتوانند در محلول هیدراته شوند یا اینکه ترکیباتی جامد را در سطح فلز تشکیل دهند. در حالت اول، اکسیداسیون ادامه پیدا میکند و حفره ایجاد شده بزرگتر میشود. در حالت دوم، با تشکیل لایهای در سطح خوردگی، مانعی برای ادامه فرآیند بوجود میآید.
سلولهای خوردگی و واکنشها
اصلیترین مشخصه این پدیده، بروز مراحل اکسایش و کاهش در بخشهایی جداگانه از سطح فلز است. این امر به دلیل خاصیت رسانایی فلزات امکانپذیر است و الکترونها میتوانند در طول فلز از یک محیط آندی به یک محیط کاتدی منتقل شوند.
در این واکنشها، حضور آب برای ادامه فرآیند الزامی است؛ اما جذب رطوبت نیز برای این امر کفایت میکند. یک سیستم خوردگی را میتوان به یک مدار اتصال کوتاه الکتروشیمیایی نسبت داد که فرآیند آندی آن به شکل زیر است:
Fe(s)→Fe2+(aq)+2e–Fe(s)→Fe2+(aq)+2e–
بخش کاتدی، شامل کاهش گاز اکسیژن است:
O2+2H2O+4e–→4OH–O2+2H2O+4e–→4OH–
همچنین این فرآیند میتواند به صورت کاهش پروتون نیز بیان شود:
H++e–→12H2(g)H++e–→12H2(g)
علاوه بر این، بخش کاتدی را میتوان به صورت کاهش یونهای یک فلز بیان کرد. در رابطه زیر، MM یک فلز است:
M2++2e–→M(s)M2++2e–→M(s)
اینکه کدام بخش از فلز به عنوان کاتد یا آند عمل کند به عوامل مختلفی بستگی دارد. گواهی بر این بحث، وجود الگوهای نامتعارف زنگزدگی در فلزات است. اتمها در مناطقی از فلز که تحت تنش قرار گرفته باشند – مانند ماشینکاری یا برش و خمش – انرژی آزاد بیشتری دارند و میتوانند به صورت آند عمل کنند.
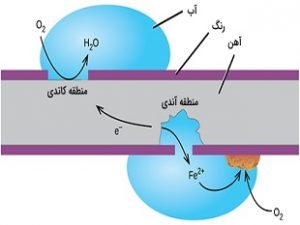
اکسیژن و خوردگی فلزات
اگر بخشی از فلز، در مقابل اتمسفر محافظت شود و در نتیجه اکسیژن کافی برای تشکیل یک لایه اکسید شده وجود نداشته باشد، این بخش محافظت شده معمولا بخشی است که بیشترین خوردگی را متحمل میشود. به بیان بهتر، این مناطق به دور از چشم قرار دارند و شناسایی این پدیده و کنترل آن در این نوع از مناطق دشوار است.
در مقابلِ قسمتهای آندی، که در محلهای مشخصی از سطح فلز رخ میدهند، بخش کاتدی فرآیند تقریبا در هر محلی بوقوع میپیوندد. با توجه به اینکه بیشتر اکسیدهای فلزی نیمههادی هستند، پوششهای اکسیدی از جریان الکترونها به سطح جلوگیری نمیکنند، بنابراین هر منطقهای که در معرض اکسیژن یا هر پذیرنده الکترونی قرار داشته باشد به عنوان کاتد عمل میکند. تمایل مناطق خالی از اکسیژن برای عمل کردن به عنوان آند، دلیل ایجاد محلهایی است که در آنها زنگ آهن مشاهده میشود.
خودروهای زنگ زده
اگر در خودروهای قدیمی دقت کرده باشید، زنگزدگی در نقاط اتصال بخشهای خودرو و حتی در زیرِ لایههای رنگ آنها وقوع پیدا میکند. همچنین زمانی که زنگزدگی اتفاق میافتد، ادامه آن به طور خود به خودی پیش میرود. یکی از دلایل وقوع این امر وجود یون هیدروکسید به عنوان محصول واکنش است. pH بالایی که در این مناطق کاتدی ایجاد شده است، لایه اکسید شده را تخریب میکند و حتی ممکن است لایههای رنگی را ضعیفتر کند که در نتیجه این امر، این مناطق میتوانند به عنوان کاتد عمل کنند. مصرف الکترونها سبب تشدید حالت کاتدی و به تبع آن تشکیل مناطق آندی بیشتر میشود.
از دلایل عمده بروز این پدیده زمانی است که دو فلز مختلف با یکدیگر در تماس باشند. این حالت بیشتر در اطراف بستها و نقاط جوش اتفاق میافتد. وجود رطوبت و نمکهای هادی الکتریسیته در خارج از سطح، موجب ایجاد حالت اتصال کوتاه در سلول و سرعتبخشیدن به خوردگی فلزات میشوند. به همین دلیل در جادههایی که از نمک برای جلوگیری از یخزدگی استفاده میکنند، سرعت خوردگی خودروها بیشتر است.
وقوع این پدیده حتی در حالتی که دو فلز در تماس مستقیم با یکدیگر نباشند نیز امکانپذیر است. به عنوان مثال در منازلی که از لولههای مسی در لولهکشی خود استفاده میکنند، همواره مقادیری از یون Cu2+Cu2+ در آب وجود دارد. زمانی که این آب با لولههای استیل و کروم در سینک ظرفشویی تماس پیدا کند، سبب ایجاد سلول خوردگی فلزی میشود. در مورادی که سینکها شامل روکش کروم باشند، نمکهای Cr3+Cr3+ تشکیل میشوند که به صورت لکههای سبز رنگ قابل تشخیص هستند.
زنگ آهن
شناختهشدهترین نوع خوردگی فلزات با نام زنگ آهن شناخته میشود. آهن به سادگی در معرض هوا و آب زنگ میزند. مراحل اصلی زنگ آهن در زیر آورده شده است. زمانی که آهن در معرض هوا و اتمسفر قرار بگیرد، به سرعت اکسید میشود:
بخش آندی:
Fe(s)→Fe2+(aq)+2e–
الکترونها در محلول اسیدی، اکسیژن هوا را کاهش میدهند:
بخش کاتدی:
O2(g)+4H+(aq)+4e–→2H2O(l)O2(g)+4H(aq)++4e–→2H2O(l)
معادله واکنش در حالت کلی به صورت زیر است:
2Fe(s)+O2(g)+4H+(aq)→2Fe2+(ag)+2H2O(l)2Fe(s)+O2(g)+4H(aq)+→2Fe(ag)2++2H2O(l)
آنچه که به عنوان زنگ آهن شناخته میشود، آهن (III) اکسید آبدار است که در واکنش آهن (II) اکسید با اکسیژن تشکیل میشود:
4Fe2+(aq)+O2(g)+(4+2x)H2O(l)→2Fe2O3⋅xH2O(s)4Fe(aq)2++O2(g)+(4+2x)H2O(l)→2Fe2O3⋅xH2O(s)
تعداد مولکولهای آب مصرف شده در واکنش متغیر است و به همین منظور با xx نشان داده شدهاند.
کنترل خوردگی فلزات
با توجه به اینکه وجود هر دو مرحله آندی و کاتدی برای وقوع این پدیده ضروری است، متوقف کردن هریک موجب توفق کل فرآیند میشود. یک استراتژی معمول این است که با رنگ کردن یا دیگر پوششها، از وقوع هر دو مرحله جلوگیری کنیم. حتی با وجود این کار، ممکن است مناطقی وجود داشته باشند که رنگ در آنها نفوذ نکرده باشد یا به طور مشخص حفرههایی در فلز وجود داشته باشند. یک روش بهتر، اعمال مقداری بار منفی به فلز، و مشکلکردن وقوع فرآیند است.
روش اول: پوشش فدا شونده
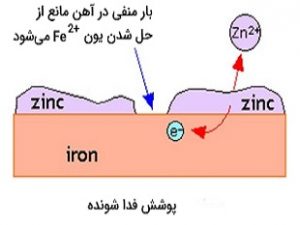
یکی از روشهای تامین بار منفی، اعمال پوششی از یک فلز فعالتر است. به طور مثال، در روش حفاظت استیل از زنگ زدن، آن را با لایهای از روی اندود میکنند. به این فرآیند «گالوانیزه کردن» (Galvanizing) میگویند. این لایه از روی، فعالیت بیشتری نسبت به آهن دارد و به اصطلاح، آهن از روی نجیبتر است. حل شدن این «پوشش فداشونده» (Sacrificial Coating)، الکترونهایی را به جا میگذارد که موجب افزایش غلظت این الکترونها در آهن میشود و به آن خاصیت کاتدی میدهد. این خاصیت، به عنوان مانعی برای انحلال آهن عمل میکند.
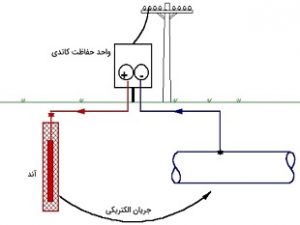
روش دوم: حفاظت کاتدی
یک استراتژی مناسب، اعمال مداوم بار الکتریکی منفی بر یک فلز است تا انحلال آن به عنوان یون مثبت مهار شود. به دلیل اینکه تمامی سطح فلز در شرایط کاتدی قرار دارند، به این روش «حفاظت کاتدی» (Cathodic Protection) میگویند. منبع تامین الکترون، میتواند یک منبع تغذیه با برق مستقیم باشد. از این روش معمولا در حفاظت لولههای انتقال نفت و دیگر ابزارآلات که در زیر زمین قرار دارند استفاده میشود. منبع دیگر میتواند خوردگی یک فلز فعالتر، مانند روی یا آلومینیوم باشد که در نزدیکی آن در زمین دفن شده است. در حقیقت، دفن کردن موجب میشود تا خاک مرطوب در نقش یک الکترولیت عمل کند. در تصویر زیر، حفاظت کاتدی برای تانکر حاوی پروپان نمایش داده شده است: