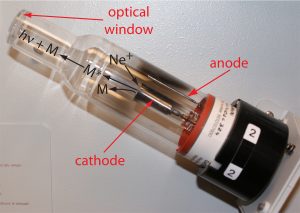
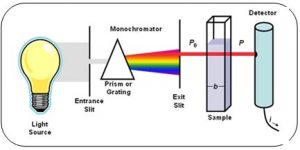
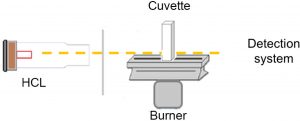
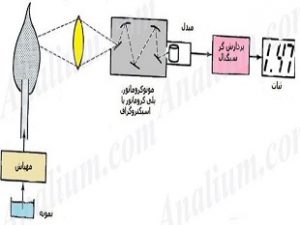
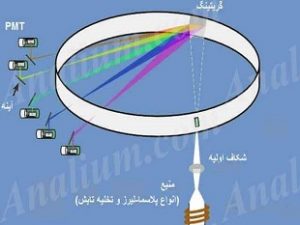
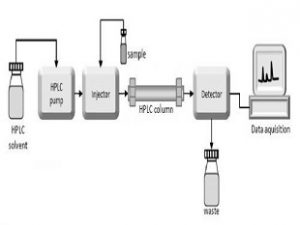
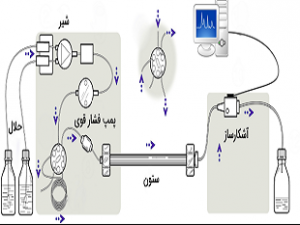
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه مهندسی شیمی
آنچه که باید درباره مبانی شیمی کوانتوم بدانید
مقدمه
کوانتوم مکانیک شاخهای از علم فیزیک است که دنیای ذرات بسیار کوچک را مورد بررسی قرار میدهد. این شاخه از فیزیک، نتایجی عجیب را در پی دارد که در دنیای واقعی قابل توجیه نیستند. در مقیاس الکترونی و اتمی، بسیاری از معادلات فیزیک کلاسیک که توصیفکننده نحوه حرکت اجسام هستند، نمیتوانند فیزیک مسائل را توصیف کنند. در فیزیک کلاسیک، یک جسم در یک لحظه مشخص، در مکانی مشخص قرار میگیرد. این در حالی است که در کوانتوم مکانیک الکترونها در فضایی احتمالی قرار دارند. در حقیقت احتمال وجود آنها در نقطه A، برابر با عددی مشخص بوده و در نقطه B، این احتمال عددی متفاوت است.
سه اصل انقلابی
فیزیک کوانتوم از ریاضیاتی برخوردار است که آزمایشهای غیر قابل توصیف در مکانیک کلاسیک را توجیه میکند. سرآغاز این علم به ابتدای قرن بیستم و به زمانی باز میگردد که آلبرت انیشتین مقالهاش را در مورد نسبیت چاپ کرد. نسبیت انیشتین توصیفکننده نحوه حرکت اجسام در سرعتهای بسیار بالا است. برخلاف نسبیت، فیزیک کوانتوم را نمیتوان به دانشمندی خاص نسبت داد، چرا که فیزیکدانان بسیاری در توسعه آن نقش داشتهاند.
در بین سالهای ۱۹۰۰ تا ۱۹۳۰ سه اصل انقلابی توسط دانشمندان، توسعه داده شدند که با استفاده از آزمایش به تدریج مورد پذیرش جامعه علمی قرار گرفتند. این سه اصل، کوانتیزه بودن مشخصههای ماده، ذرهای بودن نور و موجی بودن ماده است.
کوانتیزه بودن مشخصهها
ویژگیهایی خاص همچون موقعیت، سرعت و رنگ ممکن است به مقداری مشخص قابل اندازهگیری باشند؛ همچون حالتی را در نظر بگیرید که میخواهیم شماره تلفنی را بگیریم. در این حالت شمارهها به صورت مجزا و پشت سر هم وارد میشوند. این اصل با اصول مکانیک کلاسیک در تناقض است. در حقیقت در مکانیک کلاسیک ویژگیها در یک طیف قرار میگیرند. به منظور توصیف حالت گسستگی ویژگیها دانشمندان از کلمه کوانتیزه بودن آن ویژگی استفاده میکنند.
ذرههای نور
نور در مواردی رفتاری ذرهای را از خود نشان میدهد. در ابتدا پذیرش ذرهای بودن نور مشکل به نظر میرسید، چراکه پس از ۲۰۰ سال آزمایش، دانشمندان به این نتیجه رسیده بودند که نور از جنس موج است. این فرض دقیقا همانند حالتی است که سنگی را در آب انداخته و در نتیجه آن موج تشکیل شود. در حالت کلی قلههای نور (با توجه به موجی بودن آن) میتوانند با یکدیگر جمع شوند که منجر به افزایش شدت آن شده و یا از هم کم شوند که منجر به ایجاد تاریکی میشود.
منبع نور را میتوان همچون توپی در نظر گرفت که با نظم مشخصی به مرکز بستری از آب ضربه میزند. رنگ نور وابسته به فاصله بین قلهها است؛ توجه داشته باشید که این فاصله معادل با سرعت ضربه زدن توپ به آب است.
موجهای ماده
ماده نیز میتواند رفتاری موجی از خود نشان دهد. این گزاره خلاف آزمایشهایی است که در مدت زمان ۳۰ سال انجام شده بود. این بیان نیز بسیار عجیب بهنظر میرسد. در ادامه موجی بودن ماده و همچنین دو مورد بیان شده در بالا را با جزئیات بیشتری توضیح میدهیم.
کوانتیزه بودن مشخصهها
در سال ۱۹۰۰، فیزیکدانی آلمانی به نام ماکس پلانک به دنبال توضیح رابطه بین رنگ نور تابش شده از اجسام داغ و دمای آنها بود. او با توجه به رنگ نورهای تابششده، تلاش کرد تا این رابطه بین طیف نور و دمای جسم را فرمولبندی کند. پلانک نهایتا به این نتیجه رسید که ترکیبی از رنگهای خاص تابیده میشوند. در حقیقت او دریافت که نور به صورت ضریبی ثابت از مقداری ثابت تابش میشود. این گفته معادل با آن است که بگوییم نور به صورت ضریبی از رنگهای ثابت منتشر میشود! این گفته مغایر با فرض موجی بودن نور است؛ چرا که نور به صورت موجی بوده و باید طیفی پیوسته از رنگها را از خود ساطع کند.
چه چیزی مانع اتمها برای تابش پیوسته رنگها میشود؟ این امر بسیار عجیب به نظر میرسد و خود پلانک فرض کوانتیزه بودن را تنها حقهای ریاضیاتی میداند. معادلهای که پلانک به منظور توصیف رفتار تابشی جسم داغ ارائه داد، حاوی عددی است که بعدها در علم فیزیک بسیار موثر بود. این عدد تحت عنوان ثابت پلانک شناخته میشود.
فرض کوانتیزه بودن نور راهی را باز کرد که دانشمندان با استفاده از آن توانستند دیگر رازهای فیزیک را نیز کشف کنند. در سال ۱۹۰۷ انیشتین و پلانک فرضیاتی را در نظر گرفتند و با استفاده از آنها توانستند علت افزایش متفاوت دمای اجسام مختلف به ازای وارد کردن مقدار حرارتی یکسان به آنها را توضیح دهند.
از ابتدای دهه ۱۸۰۰، علم طیفسنجی نشان داده بود که عناصر مختلف، طیفهای خاصی از نور را جذب یا دفع میکنند. از این رو طیفسنجی، روشی قابل استناد به منظور تعیین جنس اجرامی همچون ستارگان محسوب میشد که در فاصلهای بسیار دور از زمین قرار دارند. دانشمندان همواره این سوال را در ذهن داشتند که عناصر مختلف، طیفهای خاصی از نور را نشر یا جذب میکنند. در سال ۱۸۸۸، «یوهانس ریدبرگ» (Johannes Rydberg)، دانشمند سوئدی، معادلهای را بدست آورد که با استفاده از آن امکان توجیه خطوط طیفی اتم هیدروژن وجود داشت؛ با این حال هیچکس نمیدانست که چرا این معادله کار میکند.
اولین سرنخها به منظور پاسخ به این سوال توسط نیلز بور شناسایی شد. او در سال ۱۹۱۳ فرض کوانتیزه بودن طیفها توسط پلانک را به مدل اتمی رادرفورد اضافه کرد. رادرفورد فرض کرده بود که الکترونها همچون سیارههای منظومه شمسی به دور هسته خود دوران میکنند. اما با اضافه کردن فرض کوانتیزه بودن توسط بور، او فرض کرد که الکترونها در مدارهایی مشخص محدود شدهاند. در حقیقت الکترونها میان این خطوط جابجا میشوند.
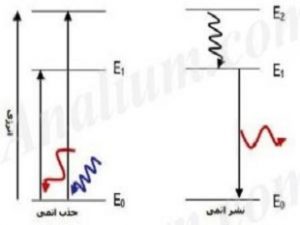
برای نمونه فرض کنید الکترونی در مداری مشخص قرار دارد. در این صورت این الکترون میتواند انرژی گرفته و به ۱ یا چند لایه بالاتر صعود کند. اگر این الکترون انرژی از دست دهد، به مدارهای پایینتر سقوط خواهد کرد. در حقیقت این صعود یا سقوط الکترونها است که منجر به جذب یا تولید نور با رنگهای مختلف میشود. این تصور از اتم، سرآغاز کشف رفتارهای کوانتومی ذرات زیراتمی بود. از این رو میتوان گفت مدل اتمی بور نقطه عطفی در توسعه مکانیک کوانتوم محسوب میشود.
ذرات نور
در سال ۱۹۰۵، آلبرت انیشتین مقالهای را با عنوان «نقطه نظری ذهنی در مورد تولید و تغییر شکل نور» (Concerning an Heuristic Point of View Toward the Emission and Transformation of Light) منتشر کرد او فرض کرد نور به صورت موجی نیست و به صورت بستههایی از انرژی منتشر میشود. انیشتین فرض کرد که میزان انتشار بستههای انرژی وابسته به مود ارتعاشی اتمها است. این جمله معادل نگاهی است که نیلز بور چند سال بعد در مورد پرش یا سقوط الکترونها بیان کرد. اگر بستههای انرژی بیان شده توسط انیشتین را به ثابت پلانک تقسیم کنیم، نوع رنگ نور بدست خواهد آمد.
این نوع نگاه به انرژی نور، انیشتین را به سمتی هدایت کرد که ۹ پدیده مختلف را توضیح دهد. یکی از این پدیدهها، رنگهایی بودند که از سیم داغ منتشر میشد. این رنگها توسط پلانک گزارش داده شده بودند. او همچنین رابطه میان نورهای رنگ مختلف و میزان الکترون جدا شده از سطح فلزات را در بستری تحت عنوان اثر فوتوالکتریک توضیح داد. جالب است بدانید که انیشتین جایزه نوبل فیزیک را در سال ۱۹۲۱ به دلیل توضیح این اثر و نه به دلیل ارائه نسبیت عام بدست آورد.
دو دهه پس از انتشار مقاله انیشتین، فوتون واژهای بود که فیزیکدانان به منظور توصیف بستههای انرژی از آن استفاده میکردند. این نامگذاری، نتیجه کارهای «آرتور کامپتون» (Arthur Compton) در سال ۱۹۲۳ بود. او نشان داد که نور پراکنده شده، در نتیجه تابش پرتویی الکترونی به آن، رنگی میشود. در حقیقت این کار نشان میدهد که ذرات نور (فوتون) به ذرات ماده (الکترون) برخورد میکنند که تاییدکننده نظر انیشتین است. پس از کار کامپون واضح بود که نور هم رفتاری موجی و هم رفتاری ذرهای دارد. از این رو دوگانگی موجی-ذرهای نور نیز یکی دیگر از ستونهای مکانیک کوانتومی بود که با این فرض ایجاد شد.
امواج ماده
از زمان کشف الکترون در سال ۱۸۹۶، شواهد مبتنی بر ساخت مواد بر اساس ذرات بنیادیتر، به آرامی در حال شکلگیری بود. حتی امروزه نیز با کشف دوگانگی موجی-ذرهای، این سوال برای دانشمندان وجود دارد که آیا ماده تنها به صورتی ذرهای رفتار میکند؟
حال تصور کنید که فرض دوگانگی برای ماده جامد نیز درست باشد. اولین دانشمندی که در مورد پاسخ به این سوال پیشرفت قابل توجهی داشت، «لویی دو بروی» (Louis de Broglie) بود. در سال ۱۹۲۴، این دانشمند از معادله ارائه شده در نسبیت خاص انیشتین به نحوی استفاده کرد که میشد با آن هم ذرهای بودن و هم موجی بودن ماده را نشان داد.
در سال ۱۹۲۵ دو دانشمند به طور جداگانه تلاش میکردند تا با استفاده از توضیح دو بروی، نحوه حرکت الکترونها اطراف اتم را توصیف کنند (پدیدهای که با استفاده از ریاضیات مکانیک کلاسیک قابل توجیه نبود). در آلمان، ورنر هایزنبرگ با استفاده از توسعه مفهومی تحت عنوان مکانیک ماتریسی شروع به توصیف نحوه حرکت الکترون کرد. فیزیکدان اتریشی، اروین شرودینگر نیز در اتریش با ایجاد بستری تحت عنوان مکانیک موجی به بررسی حرکت الکترونها پرداخت. شرودینگر در سال ۱۹۲۶ نشان داد که روش خلق شده توسط او معادل با روش مکانیک ماتریسی است.
توصیف هایزنبرگ-شرودینگر از اتم، که بیان میکرد الکترونها همچون امواج در اطراف هسته حرکت میکنند، جایگزین مدلهای اتمی بور و رادرفورد شد. یکی از الزامات مدل جدید ارائه شده این بود که دو سمت امواجی که تشکیلدهنده الکترون است، باید به یکدیگر برسد. در این حالت تنها مقادیری صحیح را میتوان برای قلهها و درههای امواج مذکور در نظر گرفت.
در توصیف هایزنبرگ-شرودینگر از اتم، الکترونها از تابع موج پیروی میکنند و به جای مدار، اوربیتالها را اشغال میکنند. بر خلاف مدارهای دایرهای مدل بور، اوربیتالهای اتمی دارای شکلهای مختلفی از جمله کرهای، دمبلی و دیگر اشکال پیچیده هستند.
در سال ۱۹۲۷، «والتر هیتلر» (Walter Heitler) و «فریتز لاندن» (Fritz London) مکانیک کوانتوم را با این هدف توسعه دادند که نحوه پیوند بین اوربیتالهای اتمها را توضیح دهند. پیوند بین اوربیتالهای اتمی منجر به تولید مولکولها میشود. این توضیح نیز بدون استفاده از مکانیک موجی امکانپذیر نبود. توضیح نحوه ایجاد پیوندهای مولکولی، شاخهای تحت عنوان شیمی کوانتومی را بوجود آورد.
اصل عدم قطعیت
در سال ۱۹۲۷، هایزنبرگ دیگر نقش مهمش را در فیزیک کوانتومی ایفا کرد. او عنوان کرد که با توجه به موجی بودن ذرات، بعضی از ویژگیهای الکترون همچون سرعت و مکان را میتوان تا حد محدودی تعیین کرد. در حقیقت هرچه دقت اندازهگیری یک پارامتر برای یک ذره بیشتر باشد، دقت اندازهگیری پارامتری دیگری کم خواهد بود. به این بیان، اصل عدم قطعیت هایزنبرگ گفته میشود. جالب است بدانید که این اصل را میتوان برای اجسامی که در مقیاس بزرگ با آنها سروکار داریم نیز بهکار برد.
طبق اصل عدم قطعیت هایزنبرگ، اگر دقت اندازهگیری سرعت یک توپ بیسبال برابر با ۰.۱ مایل بر ساعت باشد، در این صورت در بهترین حالت، دقت اندازهگیری موقعیت توپ مذکور برابر با 0.000000000000000000000000000008 میلیمتر خواهد بود!
کاربردهای فیزیک کوانتوم
امروزه استفاده از دستگاههای الکترونیکی اجتنابناپذیر شده است. یکی از قطعاتی که بهمنظور پردازش اطلاعات از آن استفاده میشود، ترانزیستور است. میتوان گفت علمکرد ترانزیستور بر اساس فیزیک کوانتوم است. همانطور که در بالا بیان شد، الکترونها خواص موجی و ذرهای را با هم دارند. در حقیقت الکترون موجی است که در اطراف هسته در حال چرخش است. از این رو میتوان از مسیر و سرعت این موج بهمنظور شناسایی رسانایی یا نارسانایی یک فلز بهره برد. بهطور دقیقتر میتوان گفت با دستکاری این موج (تغییر ناخالصی یا تحریک الکتریکی) میتوان یک ماده را بین حالت رسانا و نارسانا نوسان داد. این حالات معادل با صفر و یک در دنیای دیجیتال هستند.
همانطور که میدانید یکی از ابزارهای پرکاربرد در تلفن همراه، سیستم موقعیتیاب جهانی یا جی پی اس است. اساس کار جی پی اس مبتنی بر مفاهیم کوانتوم مکانیک است. در حقیقت یک سیستم موقعیتیاب، مبتنی بر ماهوارهها و ساعتهای اتمی کار میکند. به بیانی دقیقتر، در هر لحظه موقعیت ماهواره به تلفن همراه مخابره میشود. بهمنظور شناسایی دقیق یک موقعیت باید محاسبات هندسی مربوط به تمامی ماهوارهها انجام شده، سپس نقطه اشتراک آنها به عنوان موقعیت نهایی اعلام میشود. هماهنگی میان ماهوارهها با استفاده از ساعتهایی اتمی انجام میشود. نحوه کارکرد ساعتهای اتمی مبتنی بر فیزیک کوانتومی است. در حقیقت یک ثانیه برابر با ۹,۱۹۲,۶۳۱,۷۷۰ بار نوسان موجی است که منجر به برانگیخته شدن الکترون در اتم سزیم میشود.
احتمالا این تجربه را داشتهاید که فلش خود را به کلی پاک کنید. شاید برایتان جالب باشد که این فرآیند با استفاده از پدیدهای تحت عنوان تونلزنی کوانتومی انجام میشود. این پدیده حالتی را توصیف میکند که در آن یک الکترون میتواند از میان یک لایه نارسانا عبور کرده که به آن اصطلاحا تونلزنی کوانتومی گفته میشود. تونلزنی کوانتومی تنها با استفاده از کوانتوم مکانیک قابل توجیه بوده و فیزیک کلاسیک نمیتواند آن را توجیه کند.
البته تنها کاربرد این پدیده در پاک کردن فلش نیست! برای نمونه در دهه ۷۰ میلادی مهندسان شرکت IBM موفق به ساخت میکروسکوپی شدند که با استفاده از آن برای اولین بار امکان مشاهده اتمها بهصورت مجزا فرآهم شد. البته این پدیده میتواند جنبههایی منفی نیز داشته باشد. برای نمونه این پدیده در پردازندههای سرعت بالا پتانسیل ایجاد اتصال کوتاه را فرآهم میکند که میتواند به کل دستگاه آسیب برساند.