
پردیس فناوری کیش_طرح مشاوره متخصصین صنعت و مدیریت_گروه فنی و مهندسی
هیدروکلریک اسید:
هیدروکلریک اسید یک محلول شفاف، بیرنگ و با بوی بسیار تند از هیدروژن کلرید (HCl) در آب است. یک اسید معدنی بسیار خورنده و قوی با استفادههای صنعتی زیاد است. هیدروکلریک اسید بهطور طبیعی در اسید معده یافت میشود. پیاچ (pH) این اسید بین ۰ تا ۲ میباشد.
| اسید هیدروکلریدریک (PH1) | |
|---|---|
| نامگذاری آیوپاکHydrochloric acid | |
| دیگر نامهاMuriatic acid Spirit(s) of Salt | |
| شناساگرها | |
| شماره ثبت سیایاس | ۷۶۴۷–۰۱–۰ |
| شمارهٔ آرتیئیسیاس | MW4025000 |
| خصوصیات | |
| فرمول مولکولی | HCl in آب (H2O) |
| جرم مولی | 36.46 g/mol (HCl) |
| شکل ظاهری | شفّاف و بیرنگ تا زرد ِ روشن liquid |
| چگالی | 1.18g/cm3 |
| دمای ذوب | −27.32 °C (247 K) 38% solution. |
| دمای جوش | 110 °C (383 K) 20.2% محلول; 48 °C (321 K) 38% محلول. |
| انحلالپذیری در آب | امتزاجپذیر. |
| اسیدی (pKa) | −8.0 |
| گرانروی | 1.9 mPa·s at 25 °C 31.5% محلول |
| خطرات | |
| MSDS | External MSDS |
| طبقهبندی ئییو | C |
| کدهای ایمنی | R۳۵, R۳۷ |
| شمارههای نگهداری | S26, S۳۶, S45 |
| خطرات اصلی | Corrosive |
| لوزی آتش | 30 1COR |
| نقطه اشتعال | Non-flammable. |
| ترکیبات مرتبط | |
| دیگر آنیونها | F- Br-I- |
| مرتبط با اسید | هیدروبرومیک اسید هیدروفلوئوریک اسید هیدروژن یدید سولفوریک اسید |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| Infobox references | |

هیدروکلریک اسید از قدیم به نامهای اسیدم سالیس، موریاتیک اسید و جوهر نمک معروف بوده و از ویتریول (سولفوریک اسید) و نمک طعام به دست آمد. هیدروکلریک اسید آزاد ابتدا در قرن شانزدهم توسط آندریاس لیباویوس رسماً معرفی شد. بعدتر، توسط شیمیدانهایی مثل ژوهان رودولف گلابر، جوزف پریستلی و همفری دیوی در تحقیقات علمی شان مورد استفاده قرار گرفت.
با آغاز تولید گسترده در انقلاب صنعتی، هیدروکلریک اسید در صنایع شیمیایی به عنوان یک واکنش گر ناب در تولید مقیاس بزرگ وینیل کلرید برای پلاستیک وی.وی. سی، و MDI/TDI برای پُلی اُورِتان مورد استفاده قرار گرفت. کاربریهای زیادتری هم در مقیاس کوچک دارد که شامل خانهداری، ساخت ژلاتین و دیگر افزودنیهای غذایی، رسوبزدایی و چرم سازی میباشد. حدود ۲۰ میلیون تن از هیدروکلریک اسید سالانه در جهان تولید میشود.
همچنین گفته میشود جابر بن حیان این اسید را کشف کردهاست. از این اسید برای جرمگیری از سطوح مختلف استفاده میشود. هیدروکلریک اسید در معده نیز وجود دارد و به هضم غذا کمک میکند. تنفس بخار هیدروکلریک اسید خطرناک است و به دستگاه تنفسی آسیب میرساند و اگر قطرهای از آن بر روی پوست بدن بچکد تولید تاول و حتی جراحتهای عمیق میکند و در چنین مواردی باید بلافاصله با محلول قلیایی رقیق مانند محلول سودا یا جوش شیرین اثر اسید را خنثی کرد. گفته شده که جابر بن حیان هیدروکلریک اسید و اسیدهای دیگری مانند نیتریک اسید، سیتریک اسید (جوهر لیمو) و استیک اسید (جوهر سرکه) را میشناخته و ویژگیهای آنها را کشف کردهاست.
وجه تسمیه
هیدروکلریک اسید برای کیمیاگران اروپایی با عنوان جوهر نمک یا اسیدم سالیس (نمک اسید) شناخته شده بود. هر دو نام هنوز هم رایج هستند به خصوص در زبانهای غیر انگلیسی مثل زبان آلمانی: Salzsäure، زبان هلندی: Zoutzuur، زبان سامی شمالی: Saltsyra و زبان لهستانی: kwas solny. HCl گازی هوای اسید دریایی نامیده میشد. نام قدیمی (قبل از نام قاعده دار) موریاتیک اسید نیز ریشهٔ یکسانی دارد و بعضی اوقات به کار میرود (موریاتیک یعنی “مربوط به آب نمک یا نمک”).[۱][۲] نام «هیدروکلریک اسید» توسط شیمیدان فرانسوی ژوزف لویی گیلوساک در ۱۸۱۴ ابداع شد.[۳]
تاریخچه
تیزاب سلطانی، مخلوطی از هیدروکلریک اسید و نیتریک اسید، که با حل شدن نشادر در نیتریک اسید تهیه میشود، توسط سئودو گبر (جابر بن حیان بدلی)، شیمیدان اروپایی قرن ۱۳ تشریح شد. دیگر مراجع اذعان دارند که اولین اشاره به تیزاب سلطانی در دست خطهای موجود امپراتوری روم شرقی با تاریخ اواخر قرن سیزدهم یافت شدهاست.[۹][۱۰][۱۱]
هیدروکلریک اسید آزاد اولین بار به صورت رسمی در قرن ۱۶ توسط آندریاس لیباویوس معرفی شدهاست که آن را با گرم کردن نمک در بوته چینی خاک رسی به دست آورد.[۱۲] دیگر نویسندگان ادعا میکنند که هیدروکلریک اسید خالص اولین بار توسط کاهن بندیکتی باسیل والنتین آلمانی در قرن ۱۵،[۱۳] با گرم کردن نمک طعام معمولی و آهن(II) سولفات کشف شدهاست.[۱۴] درحالیکه دیگران مدعی اند که هیچ مرجع قابل اعتمادی راجع به اینکه هیدروکلریک اسید خالص تا اواخر قرن شانزدهم به دست آمده باشد، وجود ندارد.[۱۵]
در قرن هفدهم، ژوهان رودولف گلابر از کارل اشتات آم ماین از نمک سدیم کلرید و سولفوریک اسید برای تهیهٔ سدیم سولفات در واکنش مانهایم استفاده کرد که گاز هیدروژن کلرید آزاد میکرد. جوزف پریستلی از لیدز انگلستان، هیدروژن کلرید خالص را در ۱۷۷۲ تهیه کرد،[۱۶] و در ۱۸۰۸ همفری دیوی از پزانس انگلستان، ثابت کرده بود که ترکیب شیمیایی شامل هیدروژن و کلر بودهاست.[۱۷]
همزمان با انقلاب صنعتی در اروپا، تقاضا برای مواد قلیایی افزایش یافت. فرایند جدیدی توسط نیکولاس لبلانک (ایسودان، فرانسه) تولید ارزان قیمت و گستردهٔ سدیم کربنات (جوش شیرین) را ممکن کرد. در این فرایند لبلانک، نمک طعام با استفاده از سولفوریک اسید، سنگ آهک و زغالسنگ ضمن آزاد کردن هیدروژن کلرید به عنوان فراوردهٔ جانبی، به جوش شیرین تبدیل میشود. تا زمان قانون قلیایی ۱۸۶۳ در برتانیا و قوانین مشابه در دیگر کشورها، HCl اضافی وارد هوا میشد. بعد از قانونگذاری، تولیدکنندگان جوش شیرین مجبور به انتقال گاز اتلافی به آب و جذب آن در آب شدند تا هیدروکلریک اسید در مقیاس صنعتی تولید کنند.[۱۸]
در قرن بیستم، فرایند لبلانک جای خود را به فرایند سولوای که فراوردهٔ جانبی هیدروکلریک اسید تولید نمیکرد و مؤثرتر بود، داد. به خاطر آن که هیدروکلریک اسید همچنان به عنوان یک ماده شیمیایی مهم در کاربردهای متعدد شناخته میشد، میل تجاری روشهای تولید دیگری را نیز موجب شد که برخی همچنان به کار گرفته میشوند. بعد از سال ۲۰۰۰، هیدروکلریک اسید بیشتر با جذب هیدروژن کلرید اضافی از تولید ترکیبات آلی صنعتی تولید میگردد.[۱۸]
از ۱۹۸۸، هیدروکلریک اسید با عنوان پیشرو در جدول دوم پیمان نامه سازمان ملل علیه خرید و فروش غیرقانونی مواد مخدر و مواد روانگردان در سال ۱۹۸۸ به علت استفاده از آن در تولید و ساخت هروئین، کوکائین و مت آمفتامین ذکر شدهاست.[۱۹]
خواص شیمیایی و واکنشها
هیدروژن کلرید (HCl) اسید تک پروتونی است، به این معنی که میتواند فقط یک بار تفکیک شود (مثلاً یونیزه) تا یک یون H+ (یک پروتون تنها) آزاد کند. در هیدروکلریک اسید آبی، H+ به یک مولکول آب میپیوندد تا یک یون هیدرونیوم، H3O+ تشکیل دهد:[۲۰][۲۱] HCl + H2O → H3O+ + Cl−
دیگر یون تشکیل شده Cl−، یون کلرید است؛ بنابراین هیدروکلریک اسید میتواند برای تهیه نمکهای کلرید، مثل سدیم کلرید به کار رود. هیدروکلریک اسید یک اسید قوی است چون در اصل بهطور کامل در آب تفکیک میشود.
اسیدهای تک پروتون دار یک ثابت تفکیک اسیدی، Ka، دارد که نشانگر میزان تفکیک در آب است. برای یک اسید قوی مثل HCl، مقدار Ka بزرگ است. تلاشهای نظری برای اختصاص یک Ka به HCl انجام پذیرفتهاند.[۲۲] وقتی نمکهای کلرید مثل NaCl به HCl آبی اضافه میشوند، عملاً تأثیری بر pH ندارند، این یعنی که Cl− یک باز مزدوج بسیار ضعیف است و HCl کاملاً در محلول آبی تفکیک شدهاست. برای محلولهای متوسط تا قوی هیدروکلریک اسید، فرض اینکه مولاریتهی H+ (یک یکای غلظت) دقیقاً برابر با مولاریتهٔ HCl است، با توجه به چهار رقم معنی دار درست است.
از بین شش اسید معروف قوی از اسیدهای معدنی در شیمی، هیدروکلریک اسید، یک پروتون دارد و کمترین تمایل را به شرکت در یک واکنش اکسایش-کاهش دارد. برخلاف اسیدی بودن آن، یکی از کم خطرترین اسیدها برای استفاده است زیرا شامل یون کلرید واکنش ناپذیر و غیر سمی است. محلولهای نسبتاً قوی هیدروکلریک اسید ضمن نگهداری شان کاملاً پایدار هستند و غلظت آنها در زمان ثابت میماند. این ویژگیها به علاوهٔ این که به عنوان یک واکنشگر ناب خالص در دسترس است، هیدروکلریک را به یک واکنش گر اسیدی عالی مبدل میسازد.
هیدروکلریک اسید یک اسید مطلوب در تیتراسیون برای تعیین مقدار بازها است. تیترانتهای اسید قوی نتایج دقیق تری به خاطر نقطه پایانی متمایزشان میدهند. آزئوتروپ یا (محلول نقطه جوش ثابت) هیدروکلریک اسید (تقریباً ۲۰٫۲٪) را میتوان به عنوان استاندارد اولیه در تحلیلهای کمی به کار برد اگرچه، غلظت دقیق آن به فشار جوی که در آن تهیه شدهاست، بستگی دارد.[۲۳]
استفاده از هیدروکلریک اسید در شیمی تجزیه برای تهیه محلولها (ی “ساده”) جهت تجزیه بسیار رایج است. هیدروکلریک اسید غلیظ گاز هیدروژن، کلریدهای فلز اکسید شده و فلزهای زیادی را در خود حل میکند و با ترکیبهای بازی مثل سدیم کربنات یا مس (II) اکسید واکنش داده و کلریدهای حل شدهای را ترکیب میکند که قابل تحلیل هستند.
خواص فیزیکی
| غلظت | چگالی | غلظت مولار | پیاچ | گرانروی | ظرفیت گرمایی | فشار بخار | نقطه جوش | دمای ذوب | ||
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/dm3 | mPa•s | kJ/(kg•K) | kPa | °C | °C | |
| ۱۰٪ | ۱۰۴٫۸۰ | ۶٫۶ | ۱٫۰۴۸ | ۲٫۸۷ | −۰٫۵ | ۱٫۱۶ | ۳٫۴۷ | ۱٫۹۵ | ۱۰۳ | −۱۸ |
| ۲۰٪ | ۲۱۹٫۶۰ | ۱۳ | ۱٫۰۹۸ | ۶٫۰۲ | −۰٫۸ | ۱٫۳۷ | ۲٫۹۹ | ۱٫۴۰ | ۱۰۸ | −۵۹ |
| ۳۰٪ | ۳۴۴٫۷۰ | ۱۹ | ۱٫۱۴۹ | ۹٫۴۵ | −۱٫۰ | ۱٫۷۰ | ۲٫۶۰ | ۲٫۱۳ | ۹۰ | −۵۲ |
| ۳۲٪ | ۳۷۰٫۸۸ | ۲۰ | ۱٫۱۵۹ | ۱۰٫۱۷ | −۱٫۰ | ۱٫۸۰ | ۲٫۵۵ | ۳٫۷۳ | ۸۴ | −۴۳ |
| ۳۴٪ | ۳۹۷٫۴۶ | ۲۱ | ۱٫۱۶۹ | ۱۰٫۹۰ | −۱٫۰ | ۱٫۹۰ | ۲٫۵۰ | ۷٫۲۴ | ۷۱ | −۳۶ |
| ۳۶٪ | ۴۲۴٫۴۴ | ۲۲ | ۱٫۱۷۹ | ۱۱٫۶۴ | −۱٫۱ | ۱٫۹۹ | ۲٫۴۶ | ۱۴٫۵ | ۶۱ | −۳۰ |
| ۳۸٪ | ۴۵۱٫۸۲ | ۲۳ | ۱٫۱۸۹ | ۱۲٫۳۹ | −۱٫۱ | ۲٫۱۰ | ۲٫۴۳ | ۲۸٫۳ | ۴۸ | −۲۶ |
| دما و فشار مرجع برای جدول فوق ۲۰˚C و ۱ اتمسفر (101.325 kPa) است. مقادیر فشار بخار از جداول بینالمللی بحرانی اخذ شدهاند و همان فشار بخار کل محلول هستند. |
دمای ذوب به عنوان یک تابع از غلظت HCl در آب[۲۴][۲۵]
خواص فیزیکی هیدروکلریک اسید، مثل نقطه جوش و دمای ذوب، چگالی و pH بستگی به غلظت یا مولاریته HCl در محلول آبی دارند که از خواص آب در غلظتهای نزدیک به ۰٪ اسید تا مقادیر بخاری هیدروکلریک اسید در بیش از 40% HCl متغیر هستند.[۲۶]
هیدروکلریک اسید به عنوان مخلوط دوتایی (دو جزئی) از HCl و H2O آزئوتروپ نقطه جوش ثابتی در 20.2% HCl و ۱۰۸٫۶ ˚F (227 ˚F) دارد. چهار نقطه اوتکتیک ثابت بلوری شدن برای هیدروکلریک اسید، بین شکلهای بلور HCl•H2O (68% HCl), HCl•2H2O (51% HCl), HCl•3H2O (۴۱٪)، HCl•6H2O (25% HCl) و یخ (0% HCl) وجود دارد. هم چنین نقطه ثابت اوتکتیک در ۲۴٫۸٪ بین یخ و بلور HCl•3H2O موجود است.
تولید
هیدروکلریک اسید با حل شدن هیدروژن کلرید در آب تهیه میشود. هیدروژن کلرید را میتوان با روشهای گوناگونی تولید کرد و این یعنی راههای زیادی برای ساخت هیدروکلریک اسید موجودند. تولید مقیاس بزرگ هیدروکلریک تقریباً همیشه با تولید در مقیاس صنعتی دیگر مواد شیمیایی انجام میپذیرد.
بازار صنعتی
هیدروکلریک اسید در محلولهای تا ۳۸٪ از HCl (مقدار غلیظ) تهیه میشود. غلظتهای بیشتر فقط تا ۴۰٪ از نظر شیمیایی قابل تولید هستند، اما نرخ تبخیر از آن به بعد به قدری بالا است که نگهداری و استفاده از آن نیازمند ملاحظات اضافی تری است مثل دمای پایین و فشار بالا. پس میزان عمدهٔ صنعتی آن ۳۰٪ تا ۳۴٪ است که با توجه به حمل و نقل مناسب و اتلاف مادهٔ محدود به علت بخارهای HCl بهینه شدهاست. غلظتهای بیشتر را به جهت کنترل اتلاف از طریق تبخیر باید فشرده و سرد نمود. در ایالات متحده، محلولهای بین ۲۰٪ تا ۳۲٪ با نام اسید موریاتیک فروخته میشوند. محلولهای مورد استفاده اغلب برای نظافت خانهها در ایالات متحده، معمولاً ۱۰٪ تا ۱۲٪ هستند که هشدارهای جدی برای رقیقتر کردن شان قبل از استفاده دارند. در بریتانیا، که با نام «جوهر نمک» برای نظافت خانگی فروخته میشود، قدرت اسید برابر همان مقدار در ایالات متحده است.
تولیدکنندگان بزرگ جهانی شامل شرکت داو کمیکال ۲ میلیون تن در سال از HCl گازی، شرکت جرجیا گالف، شرکت توسوه، آکزونوبل و تساندرلو بین ۰٫۵ تا ۱٫۵ میلیون تن در سال تولید دارند. تولید کل جهان، که برای استفادههای آماری بر اساس میزان HCl توصیف شدهاست، حدود ۲۰ میلیون تن در سال تخمین زده میشود که ۳ میلیون تن از طریق تولید مستقیم و مابقی از طریق استفاده از ترکیبهای آلی و مشابه و تولید فراوردهٔ ثانوی تأمین میگردند. تا کنون، غالب هیدروکلریک اسید منحصراً توسط تولیدکننده مصرف میشود. میزان آن در بازار آزاد جهانی ۵ میلیون تن در سال تخمین زده میشود.
اسیدشویی فولاد
یکی از مهمترین استفادههای هیدروکلریک اسید در اسیدشویی فولاد است تا زنگ یا اکسید آهن را از روی آهن یا فولاد قبل از ورود آنها به واکنشهای بعدی مثل اکستروژن، نورد، “گالوانی کردن و دیگر تکنیکها، بزداید. HCl در کیفیت فنی با غلظت معمولاً ۱۸٪ رایجترین عامل اسیدشویی برای اسیدشویی فولادهای کربنی است. Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
اسید مصرف شده استفادهٔ بسیاری در محلولهای کلرید آهن (II) (هم چنین معروف به فررو کلرید) دارد اما مقادیر بالای فلزات سنگین در مایع اسیدشویی این عملیات را با مشکل مواجه کردهاست.
صنعت اسیدشویی فولاد فرایندهای بازسازی هیدروکلریک اسید را بهبود بخشیدهاست، مثل فرایند بازسازی HCl سرخکنندهٔ اسپری یا بستر سیال که بازیافت HCl را از مایع اسیدشویی مصرف شده ممکن میسازد. رایجترین فرایند بازسازی فرایند پیروهیدرولیز طی واکنش زیر است: 4 FeCl2 + 4 H2O + O2 → 8 HCl+ 2 Fe2O3
با بهبودی اسید مصرف شده یک حلقه اسیدی بسته ساخته میشود. فراوردهٔ جانبی اکسید آهن (II) از واکنش بازسازی باارزش است چون در بسیاری از صنایع ثانوی به کار میرود.
تولید ترکیبات آلی
دیگر استفاده مهم هیدروکلریک اسید در تولید ترکیبات آلی، مثل وینیل کلرید و دی کلرواتان برای پلی وینیل کلراید (PVC) است. معمول این کار یک استفادهٔ غیرآزاد است زیرا مصرف محلی هیدروکلریک اسید تولید شده در واقع به بازار آزاد نمیرسد. دیگر ترکیبات آلی تولید شونده توسط هیدروکلریک اسید عبارتند از بیسفنول ای برای پلی کربنات، کربن فعال و اسید اسکوربیک مثل تولیدات متعدد داروهای شیمیایی. 2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O (دی کلرواتان توسط اکسی کلری شدن)
چوب + HCl + حرارت ← کربن فعال (فعال سازی شیمیایی)
تولید ترکیبات غیرآلی
محصولات زیادی توسط هیدروکلریک اسید طی یک واکنش اسید و باز طبیعی منجر به ترکیبات معدنی (غیرآلی) تولید میشوند و هم چنین مواد شیمیایی درگیر با آب مثل کلرید آهن (III) و پلی آلومینیوم کلراید (PAC). Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (کلرید آهن (III) از مگنتیت)
کلرید آهن (III) و PAC هر دو به عنوان عوامل لخته سازی و انعقاد در تصفیه آب و فاضلاب، تولید آب آشامیدنی و تولید کاغذ به کار میروند. دیگر ترکیبات معدنی تولید شونده با هیدروکلریک اسید شامل کلرید کلسیم، نمک پخش در جاده، کلرید نیکل (II) برای آبکاری الکتریکی و کلرید روی برای صنعت گالوانی کردن و تولید باتری هستند. CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (کلرید کلسیم از سنگ آهک)
کنترل pH و خنثی سازی
هیدروکلریک اسید هم چنین برای تنظیم اسیدی بودن (pH) محلولها به کار میرود. OH− + HCl → H2O + Cl−
در خلوص مورد نیاز صنایع (غذایی، دارویی، آب آشامیدنی)، هیدروکلریک اسید با کیفیت برای تنظیم pH فرایند جریانهای آبی مورد استفاده قرار میگیرد. در صنایع کمتقاضا، هیدروکلریک اسید با کیفیت فنی برای خنثی سازی جریانهای اتلافی و مراقبت از استخر شنا به کار گرفته میشود.
بازسازی مبدلهای یونی
هیدروکلریک اسید پر کیفیت در بازسازی یک رزین مبدل یون به کار گرفته میشود. تبادل کاتیون بهطور گسترده برای حذف یونهایی مثل Na+ و Ca2+ از محلولهای آبی در تولید آب معدنی شده مورد استفاده قرار میگیرد. اسید برای شستن کاتیونها از رزینها به کار میرود. Na+ با H و Ca2+ با 2Hجایگزین میشود.
مبادله میشوند. مبدلهای یونی و آب معدنی در تمام صنایع شیمیایی، تولید آب آشامیدنی و اکثر صنایع غذایی مورد استفاده قرار میگیرند.
دیگر کاربردهای هیدروکلریک اسید
هیدروکلریک اسید در تعداد زیادی از کاربریهای مقیاس کوچک مثل فرایند چرم سازی، خالص سازی نمک طعام، نظافت و خانهداری،[۲۷] و بنای ساختمانها به کار میرود. تولید نفت را میتوان با تزریق هیدروکلریک اسید در بستر صخرهای یک چاه نفت، حل کردن یک بخش از صخره و ساختن یک منفذ بزرگ تحریک کرد. اسیدزنی چاه نفت یک فرایند معمول در صنعت تولید نفت دریای شمال است.
هیدروکلریک اسید برای حل کردن کلسیم کربنات نیز به کار میرود به عنوان مثال برای پوسته پوسته کردن کتریها و برای پاک کردن ملات از آجرکاریها. البته یک مایع خطرناک است که باید با دقت کافی از آن استفاده کرد. ضمن استفاده روی یک آجرکاری، واکنش آن با ملات تا جایی که کل اسید تبدیل شود ادامه مییابد و کلسیم کربنات، کربن دیاکسید و آب را به همراه دارد:
2HCl + CaCO3 → CaCl2 + CO2 + H2O
اکثر واکنشهای شیمیایی هیدروکلریک اسید در تولید غذا، مواد تشکیل دهنده غذا و افزودنیهای غذایی به کار گرفته میشوند. محصولات رایج عبارتند از آسپارتام، فروکتوز، سیتریک اسید، لیزین، پروتئین گیاهی هیدرولیز شده با اسید به عنوان مقوی غذایی، و در تولید ژلاتین. هیدروکلریک اسید مورد استفاده در صنایع غذایی (خیلی خالص) را میتوان موقع نیاز برای محصول نهایی به کار برد.
در سیاره زهره ابرهایی از هیدروکلریک اسید با غلظت کم وجود دارد.
نقش بیولوژیک
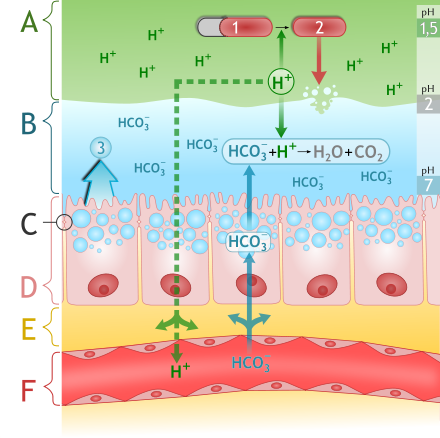
نمودار غشاء مخاطی قلیایی در معده با مکانیزمهای دفاعی مخاطی
اسید معده یکی از ترشحات اصلی معده است و بهطور عمده شامل هیدروکلریک اسید بوده و محتوای معده را طوری اسیدی میکند که پی اچ بین ۱ و ۲ داشته باشد.[۲۸][۲۹]
یونهای کلرید (Cl−) و هیدروژن (H+) در ناحیهٔ بالایی معده توسط یاخته جداری از مخاط اسید معده ترشح میشوند و به سمت یک شبکهٔ ترشحی به نام کانالیکولی قبل از اینکه وارد حفره پایینی معده شوند، هدایت میشوند.[۳۰]
اسید معده مانند یک سد مقابل ریزاندامهها برای جلوگیری از عفونتها ظاهر میشود و برای هضم غذا اهمیت زیادی دارد. پی اچ پایین آن پروتئینها را دناتوره میکند و در نتیجه آنها را برای تخریب توسط آنزیمهای گوارشی مثل پپسین حساس میکند. پی اچ پایین هم چنین آنزیم پیشروی پپسینوژن را فعال و تبدیل به آنزیم فعال پپسین (با خودشکافی) میکند. بعد از ترک معده، هیدروکلریک اسید کیموس توسط سدیم بی کربنات در دوازدهه خنثی میشود.
خود معده با ترشح لایهٔ ضخیم مخاط، و با سکرتین ناشی از محلول بافر سدیم بی کربنات در مقابل این اسید قوی از خود محافظت میکند. سوزش یر دل یا زخم معده وقتی این مکانیزمها دچار مشکل شوند، رخ میدهند. داروهای آنتی هیستامین و دستههای مهارکنندههای پروتون پمپ میتوانند تولید اسید در معده را مهار کنند، و آنتاسیدها نیز برای خنثی تر کردن اسید موجود مورد استفاده قرار میگیرند.[۳۱]
ایمنی
| غلظت بر حسب وزن | طبقهبندی[۳۲] | کد ایمنی |
|---|---|---|
| ۱۰–۲۵٪ | محرک (Xi) | R36/37/38 |
| > ۲۵٪ | خورنده (C) | R۳۴ R۳۷ |
هیدروکلریک اسید غلیظ (هیدروکلریک اسید بخار) مههای اسیدی تشکیل میدهد. مه و محلول هر دو تأثیر خورنده بازگشتناپذیری بر بافت انسان با قابلیت تخریب اندامهای تنفسی، چشمها، پوست و رودهها دارند. پس از اختلاط هیدروکلریک اسید با مواد شیمیایی اکسیدکنندهٔ معمول مثل سدیم هیپوکلریت (سفیدکننده، NaClO) یا پتاسیم پرمنگنات (KMnO4)، گاز سمی کلر تولید میشود. NaClO + 2 HCl → H2O + NaCl + Cl22 KMnO4 + 16 HCl → 2 MnCl2 + 8 H2O + 2 KCl + 5 Cl2
تجهیزات ایمنی مثل دستکشهای لاستیکی یا PVC، عینکهای ایمنی محافظ چشم و کفشها و لباسهای مقاوم در برابر مواد شیمیایی برای به حداقل رساندن خطرات استفاده از هیدروکلریک اسید به کار میروند. آژانس حفاظت محیط زیست ایالات متحده آمریکا هیدروکلریک اسید را یک مادهٔ سمی معرفی کرده و مقررات آن را تنظیم مینماید.[۳۳]
شماره بینالمللی کالاهای خطرناک یا شمارهٔ وزارت ترابری آمریکا (DOT) آن ۱۷۸۹ است. این شماره روی یک پلاکارد بر روی محفظه نمایش داده میشود.
