پردیس فناوری کیش-طرح مشاوره متخصصین صنعت و مدیریت-(گروه مهندسی شیمی)
دیدکلی
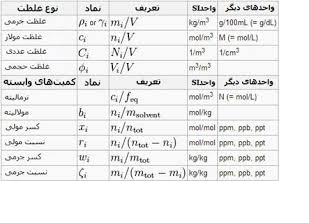
یک محلول را میتوان به عنوان مخلوط همگنی از دو یا چند ماده تعریف کرد. درمحلول گاز – مایع یا جامد – مایع معمولا مایع ، حلال و جز دیگر ماده حل شونده میباشد. اما دریک مخلوط مایع – مایع انتخاب جز حلال و حل شونده دشوار است. مگر اینکه مقدار یکی بیشتر از دیگری باشد. وقتی در مورد محلولها بحث میشود. اولین چیزی که به ذهن میآید غلظت آنها میباشد. غلظت عبارت است از مقادیر نسبی اجزا موجود در یک محلول. مثلا محلولی که شامل مقدار کمی ماده حل شده باشد، محلول رقیق میباشد یا اگر مقدار ماده حل شده بیشتر شود، محلول غلیظ نامیده میشود. خواص محلولها به مقادیر نسبی ماده حل شده در حلال بستگی دارد. برای همین است که درکارهای کمی مربوط به محلولها ابتدا باید غلظتها را مشخص کرد.
!روشهای مختلف بیان غلظت
مولاریته
مولاریته یک محلول عبارت است از مقدار مولهای جسم حل شده در یک لیتر از محلول. این غلظت را به صورت میلی مول حل شده در میلی لیتر هم بیان میکنند و یکی از پر کاربردترین مفاهیم غلظت در شیمی تجزیه میباشد. این تعریف بر اساس حجم کل محلول استوار است. وقتی غلظت محلول بر حسب مولاریته بیان میشود، محاسبه مقدار ماده حل شده موجود در یک نمونه معین از محلول آسان است. تعداد مولهای جسم حل شده از تقسیم کردن وزن آن بر حسب gr به وزن فرمولی آن (وزن مولکولی ، وزن اتمی ، وزن یونی) بدست میآید.
وزن فرمولی/ وزن جسم حل شده =تعدادمولها g r / lit لیترمحلول/ مقدارمولهای ماده حل شده=M مولاریته !! نرمالیته: نرمالیته یک محلول برابراست با ارزگرمهای (اکی والان گرمهای) ماده حل شده دریک لیترازمحلول. وزن اکی والان شیمیایی یک ماده بستگی به واکنشی دارد که درآن شرکت کرده است. به عنوان مثال اگر اسیدسولفوریک در واکنش ختثی شدن شرکت کند، هم ارز شیمیایی آن نصف وزن مولکولی آن می باشد.
وزن اکی والان گرم یک ماده برحسب نوع واکنش تعیین می شود.
لیترمحلول/ شماراکی والان جسم حل شده = N نرمالیته
به عنوان مثال وزن اکی والان ماده ای که درواکنش خنثی شدن شرکت می کند عبارت از وزنی ازآن ماده است که درآن واکنش بایک وزن فرمول گرم یون هیدروژن ترکیب می شود.
n = تعداد هیدروژنهای اسید-تعداد OH باز-ظرفیت فلز درنمک-عدداکسیداسیون و …
برحسب نوع واکنش n تعیین می شود.
مولالیته: مولالیته یک محلول عبارت است از عددمولهای حل شده در g r 1000 حلال. مولالیته یک محلول آبی بسیار رقیق همان مولاریته آن محلول است زیرا g r 1000 آب تقریبا ml 1000 حجم اشغال می کند.
gr/ mol gr 1000 حلال / تعداد مولهای ماده حل شده = m مولالیته
درصد وزنی
درصد وزنی یک ماده حل شده دریک محلول عبارتست از:
گرمهای حلال+گرمهای جسم حل شده/ گرمهای جسم حل شده×100 = W% درصد وزنی
درصد وزنی معمولا برای بیان غلظت تجارتی محلولهای آبی در واکنشگرها به کار می رود و به عنوان مثال اسیدنیتریک به صورت محلول 70% به فروش می رسد که در100 گرم آن ، 70 گرم اسیدنیتریک وجود دارد.
درصد حجمی
عبارت است از لیترجسم حل شده برلیترمحلول ضربدرصد.
100×لیترمحلول/ لیتر جسم حل شده = V o l %
گرم برحجم
عبارت است از مقدارگرمهای جسم حل شده دریک لیترمحلول. لیترمحلول/ گرم جسم حل شده=C
درصد وزنی-حجمی
100×حجم محلول به میلی لیتر/ وزن ماده حل شده به گرم=درصدوزنی-حجمی ( V/ W )
این غلظت برای بیان ترکیب محلولهای آبی رقیق و واکنشگرهای جامد به کار می رود بنابراین یک محلول آبی 5% از نیترات نقره محلولی می باشد که ازحل کردن 5 گرم نیترات نقره درمقدارکافی آب مقطر برای تولید 100 میلی لیتر محلول استفاده شده است.
کسرمولی
کسرمولی یک جزء سازنده محلول ، نسبت عده مولهای آن جزء به تعدادکل مولهای تمام اجزاء موجود درمحلول می باشد.
کل مولهای اجزاء موجود درمحلول … n c+ nB+ nA / تعدادمولهای A nA= X_A کسرمولی جسم A
فرمالیته یا غلظت نرمال
فرمالیته عبارت است از مقدار وزن فرمولی ازیک ماده حل شده برحسب گرم دریک لیترمحلول.
لیترمحلول/ ( gFW )= فرمالیته( F)وزن مولکولی/ گرمهای نمونه حل شده = وزن فرمول گرمی ( g FW )
قسمت درمیلیون یا p pm
عبارت است از وزن جسم حل شده برحسب میلی گرم در یک لیتر از محلول.
لیترمحلول/ میلی گرم جسم حل شده = p pm
غلظت مولار و غلظت نرمال پرکاربردترین واحدهای غلظت در تهیه محلولها می باشند.