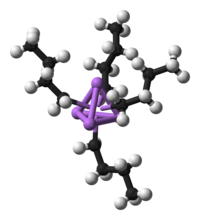
شیمی آلی فلزی (به انگلیسی: Organometallic Chemistry)، شیمی ترکیباتی است که حداقل یک پیوند کربن _ فلز داشته (C-M) و شامل فلزات واقعی و شبه فلزات از قبیل Si، As، B و فلزات واسطه باشند. بنابراین این پیوند میتواند یک پیوند کووالانسی ساده باشد. مانند پیوند در تترااتیل سرب. یا یک پیوند داتیو باشد، مانند پیوند در فروسن یا حتی یونی باشد، مانند پیوند در اتیل سدیم. ان-بوتیللیتیوم یک ترکیب آلی فلزی است. در این ترکیب چهار اتم لیتیوم (به رنگ ارغوان) یک ساختار چهاروجهی تشکیل داده اند و چهار گروه بوتیل با وجوه این چهار وجهی پیوند تشکیل داده اند. اتم های کربن به رنگ مشکی و اتم های هیدروژن به رنگ سفید هستند.
تاریخچه
شیمی آلی فلزی را به شیمیسیت انگلیسی «فرانکلند» (Frankland) نسبت میدهند. او در سال ۱۸۴۹ دیاتیل روی را سنتز نمود و سپس استفاده از ترکیبات آلی روی را در سنتز مواد آلی توسعه داد. نمک زایس (K[Pt(C2H4)Cl۳]) نیز بیش از یک قرن است که شناخته شدهاست.
در اوایل قرن اخیر (۱۹۰۰ میلادی) شیمیست فرانسوی ویکتور گرینیارد روش مناسبی جهت تهیه ارگانو منیزیم هالید را توسعه داد، بهطوری که بزودی بجای ترکیبات آلی روی به عنوان حد واسط در سنتز ترکیبات آلی مورد استفاده قرار گرفت. سنتز اتفاقی فروسین در سال ۱۹۵۱ و شناخته شدن متعاقب ساختمان مولکولی آن راه تحقیق را برای زمینهای با تنوع غیرقابل پیشبینی هموار کرد که اهمیت بسزایی در درک ما از پیوندهای شیمیایی داشتهاست.
خواص ترکیبات آلی فلزی
شباهت ترکیبات آلی فلزی از نظر خواص فیزیکی به ترکیبات آلی در مقایسه با ترکیبات معدنی بیشتر است. بسیاری از این ترکیبات دارای ساختار مولکولی منفک هستند و در نتیجه در دماهای معمولی به صورت بلورهایی با نقطه ذوب پایین، مایعات یا گازها دیده میشوند. این ترکیبات معمولاً در حلالهای آلی کم قطبی از قبیل تولوئن، اترها یا دیکلرو متان قابل حل هستند.
از نظر خصوصیات شیمیایی، تفاوت قابل ملاحظهای بین ترکیبات آلی فلزی وجود دارد و مثلاً، پایداری حرارتی آنها بهطور قابل ملاحظهای به ترکیب شیمیایی آنها بستگی دارد. از این رو، تترامتیل سیلان پس از چندین روز نگهداری در دمای ۵۰۰ درجه سانتیگراد بلا تغییر میماند، در حالی که تترامتیل تیتان در دمای اتاق سریعاً تجزیه میشود.
پایداری در برابر اکسایش
کلیه ترکیبات آلی فلزی از دیدگاه ترمودینامیکی اکسایش ناپایدار هستند. نیروی محرکه لازم برای اکسایش این ترکیبات به واسطه تشکیل اکسید فلز، دیاکسید کربن و آب که انرژی آزاد منفی بالایی دارند، تأمین میشود. همچنین بیشتر این ترکیبات از دیدگاه سینتیکی در دمای اتاق یا پایینتر در مقابل اکسایش ناپایدار هستند. اغلب این ترکیبات مانند دی متیل روی، تری متیل قلع، تری متیل ایندیوم به خودی خود در هوا آتش میگیرند. همچنین بیشتر مشتقات فلزات واسطه در برابر اکسیژن حساس هستند و معمولاً متداول و غالباً ضروری است که این مشتقات، زیر اتمسفر بیاثری از گاز نیتروژن یا آرگون مورد بررسی و مطالعه قرار بگیرند.
پایداری در برابر آبکافت
سرعت آبکافت یک ترکیب آلی فلزی به قطبیت پیوند C-M آن بستگی دارد. مثلاً وقتی قطبیت پیوند زیاد باشد (مثلاً در تری متیل آلومنیوم) حمله مولکولهای آب بهطور سریع انجام میگیرد، در صورتی که تری متیل بور در دمای اتاق با وجود داشتن یک اوربیتال خالی ۲P در اتم بور تحت تأثیر مولکولهای آب قرار نمیگیرد. اکثر مشتقات آلی فلزات واسطه خنثی در مقابل فرایند آبکافت بیاثر هستند، ولی لانتانیدهای آلی بشدت، مستعد آبکافت میباشند و علت آن را میتوان به خاصیت قطبی پیوند، اندازه بزرگتر اتم مرکزی و حضور تعداد زیاد اوربیتالهای خالی کم انرژی نسبت داد.
طبقهبندی ترکیبات آلی فلزی
مشتقات عناصر گروه اصلی عناصر اصلی در گروهها (که فقط با الکترونهای s و p پیوند تشکیل میدهند.) عموماً پیوندهای کووالانسی سیگما با کربن تشکیل میدهند، باستثنای فلزات قلیایی و قلیایی خاکی با کربن عمدتاً یونی است. ساختمانهایی که کمبود الکترون دارند، به وسیلهٔ عناصری از قبیل Al، Mg، Be ،Li تشکیل میشوند و ترکیبات خوشهای را تولید میکنند.
مشتقات عناصر واسطه
در مورد فلزات واسطه (که برای تشکیل پیوند از اوربیتالها و الکترونهای d و در صورت لزوم f استفاده میکنند) معمولاً کمپلکسهای π دارنده پیوندهای داتیو تشکیل میشود. به عبارت دیگر، عناصر واسطه d اغلب نه تنها دارای پیوندهای سیگما بوده، بلکه پیوندهایی از نوع π نیز دارند. به عبارت سادهتر، پیوند بین اتمهای واسطه و مولکولهای آلی اشباع نشده به وسیلهٔ تبادل الکترون در دو جهت مخالف تشکیل میشود.
سادهترین مثال پیوندی است که بین مونوکسید کربن و اتم فلز در کربونیلهای فلزی تشکیل میشود. در این گونه پیوندها فلز باید اوربیتالهای خالی d داشته باشد، تا بتواند الکترونهای داده شده توسط CO را بپذیرد و نیز باید اوربیتالهای اشغال شده d داشته باشد، تا بتواند الکترونهای خود در اوربیتال d را به لیگاند بدهد.
برخی از کاربردهای ترکیبات آلی فلزی
استفاده از ترکیبات آلی سیلسیم به عنوان واسطه در تهیه پلیمرهای سیلسیم (سیلیکونها).
استفاده از آلومینیوم آلکینها به عنوان کاتالیزور در پلیمر کردن و الیگومر کردن اولفینها در مقیاس وسیع.
استفاده از تترااتیل سرب و تترامتیل سرب برای بالا بردن درجه اکتان بنزین.
استفاده از مشتقات آلی فلزات واسطه در داروسازی در سطح گسترده
استفاده از ترکیبات آلی ایریدیوم و روتنیوم در مقابله با مقاومت دارویی
استفاده از ترکیبات آلی قلع به عنوان آفت کش و پایدارکننده پلیمرها.
کربونیل دار کردن متانول جهت تولید اسید استیک. از اسید استیک در تهیه پلی وینیل استات و محصول آبکافت آن یعنی پلی وینیل الکل، استفاده میگردد و همچنین در تهیه انیدرید استیک که مورد نیاز صنایع تولیدکننده الیاف استات سلولز و پلاستیکها میباشد، کاربرد دارد و نیز در تهیه استرهای استات که یکی از حلالهای صنعتی مهم بهشمار میرود، از اسید استیک استفاده میشود.